题目内容
下列液体均处于25℃,有关叙述不正确的是
| A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-) |
B
解析试题分析:A.pH=4.5的番茄汁中c(H+)=10-4.5mol/L; pH=6.5的牛奶中c(H+)=10-6.5.前者的c(H+)比后者大102倍,因此c(H+)前者是后者的100倍。正确。B.在室温下,纯水中水电离产生的c(H+)=10-7mol/L.而某物质的溶液中由水电离的c(H+)=1×l0-12mol/L<10-7mol/L,水的大量受到了抑制。可能的外加了酸,也可能是外加了碱。因此该物质可能是酸溶液也可能是碱溶液。错误。C.AgCl在水中存在沉淀溶解平衡:AgCl(s) Cl-(aq)+Ag+(aq)当水中存在Cl-时,AgCl的沉淀溶解平衡受到抑制,溶解度会减小。由于在同浓度的CaCl2和NaCl溶液中Cl-的浓度不同,对沉淀溶解平衡的抑制程度就不同。因此AgCl的溶解度不相同。正确。D. 在溶液中存在电荷守恒即c(Na+)+ c(H+) <c(OH-)+c(CH3COO-)。因为在CH3COOH与CH3COONa混合溶液中,pH=5.6,则溶液显酸性,c(H+)>c(OH-),所以c(Na+) < c(CH3COO-)。正确。
Cl-(aq)+Ag+(aq)当水中存在Cl-时,AgCl的沉淀溶解平衡受到抑制,溶解度会减小。由于在同浓度的CaCl2和NaCl溶液中Cl-的浓度不同,对沉淀溶解平衡的抑制程度就不同。因此AgCl的溶解度不相同。正确。D. 在溶液中存在电荷守恒即c(Na+)+ c(H+) <c(OH-)+c(CH3COO-)。因为在CH3COOH与CH3COONa混合溶液中,pH=5.6,则溶液显酸性,c(H+)>c(OH-),所以c(Na+) < c(CH3COO-)。正确。
考点:考查离子浓度的大小比较、沉淀溶解平衡的知识。

由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验: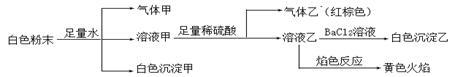
以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B.气体乙一定是NO和NO2的混合气体 |
| C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D.白色粉末中一定含有Na+ 、Al3+ 、NO2- |
25℃时,下列各溶液(均为0.1 mol·L-1)中,离子(或分子)的物质的量浓度关系正确的是
| A.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1 |
| C.醋酸钠溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| D.碳酸氢钠溶液中:c(Na+)-c(OH-)=c(HCO3-)+c(CO32-)-c(H+) |
下列有关实验的叙述正确的是
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是 ( )
| A.FeCl3与FeCl2 | B.KHCO3与KOH | C.NH4Cl与NaCl | D.AlCl3与Al2(SO4)3 |
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
| A.强酸溶液产生较多的氢气 | B.两者产生等量的氢气 |
| C.无法比较两者产生氢气的量 | D.弱酸溶液产生较多的氢气 |
氯化钴溶液中存在下列平衡:CoCl42-(蓝色) Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
| A.由蓝色变为粉红色 | B.红色加深 |
| C.由粉红色变为蓝色 | D.蓝色加深 |
常温下,0.1mol/L的氨水pH=11,下列叙述错误的是
| A.向该溶液中加水稀释:c(OH—)/c(NH3·H2O )增大 |
| B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42—)+c(OH—) |
| C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液中:c(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—) |
| D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
| A.溶液的pH相同 |
| B.分别加入足量锌片,盐酸生成的H2体积大 |
| C.分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D.由水电离出的氢离子浓度均为1×10-12 mol·L-1 |