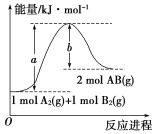
题目内容
【题目】据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___,Zr2+的价电子排布图是___。
(2)O、Se、Te的第一电离能由大到小的顺序是___,H2O、H2Se、H2Te的沸点由高到低的顺序是___。
(3)H2Te和CO2 均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___。
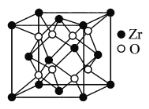
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
【答案】12 ![]() O>Se>Te H2O>H2Te>H2Se H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° O 16 8
O>Se>Te H2O>H2Te>H2Se H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° O 16 8 ![]() =
=![]()
【解析】
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中3d轨道上的电子数是10,4d轨道上的电子数是2,d轨道上的电子数一共12个,Zr2+的价电子排布图是![]() 。故答案为:12 ;
。故答案为:12 ;![]() ;
;
(2)O、Se、Te处于同主族,同主族自上而下电离能降低,第一电离能由大到小的顺序是O>Se>Te;H2O受氢键影响,所以沸点最高。H2Se、H2Te的沸点主要受范氏力影响,分子量越大,沸点越高。H2O、H2Se、H2Te的沸点由高到低的顺序是H2O>H2Te>H2Se。故答案为:O>Se>Te;H2O>H2Te>H2Se;
(3)H2Te中Te原子价层电子对个数=2+![]() =4,有两对孤电子对,分子为V形结构,CO2 中C原子价层电子对个数=2+
=4,有两对孤电子对,分子为V形结构,CO2 中C原子价层电子对个数=2+![]() =2,分子为直线型,H2Te和CO2 均为三原子分子,但它们的键角差别较大,理由是 H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° 。故答案为: H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° ;
=2,分子为直线型,H2Te和CO2 均为三原子分子,但它们的键角差别较大,理由是 H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° 。故答案为: H2Te中Te为sp3杂化,由于两对孤电子对的排斥作用使其键角小于109°28,CO2中C为sp杂化,键角为180° ;
(4)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,配体中O原子含有孤电子对,所以配原子为O原子;1个[Zr(C2H5O)2]2+离子中同种非金属元素之间形成非极性键、不同非金属元素之间形成极性键,共价单键为σ键,该离子的结构是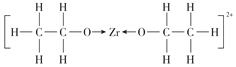 含共价键的数目是16。故答案为:O;16;
含共价键的数目是16。故答案为:O;16;
(5)该晶胞中Zr原子个数=8×![]() +6×
+6×![]() =4、O原子个数为8,Zr、O原子个数之比=4:8=1:2,锆原子的配位数是8,若晶胞中距离最近的两个氧原子间的距离为anm,这两个氧原子之间的距离为晶胞棱长的一半,则晶胞棱长为2anm,晶胞体积=(2a×10-7cm)3,则立方氧化锆的密度=
=4、O原子个数为8,Zr、O原子个数之比=4:8=1:2,锆原子的配位数是8,若晶胞中距离最近的两个氧原子间的距离为anm,这两个氧原子之间的距离为晶胞棱长的一半,则晶胞棱长为2anm,晶胞体积=(2a×10-7cm)3,则立方氧化锆的密度=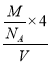 =
=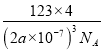 g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。
故答案为:8; ![]() =
=![]() g·cm-3。
g·cm-3。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为___,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是__。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
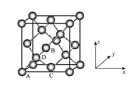
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为__g·cm-3(列出计算式即可)。