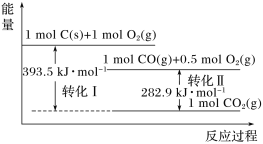
题目内容
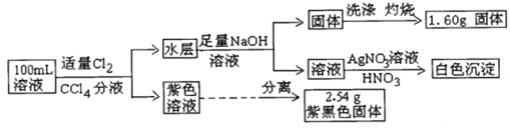
【题目】常温下,有pH=1的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下实验:根据实验结果,下列判断正确的是( )
A.Fe2+,I-,Cl-三种离子一定存在B.不能确定Na+和Cl-是否存在,CO32-一定不存在
C.Fe3+与Fe2+至少有一种D.该溶液中c(Cl-)≥0.1molL-1
【答案】A
【解析】
pH=1的溶液显酸性,含有大量的H+,且n(H+)=0.1mol×0.1L=0.01mol;根据离子共存可得,原溶液中一定不含有CO32-;加入适量Cl2和CCl4分液后,得到紫色溶液,说明溶液中含有I-,根据离子共存可得,溶液中一定不含有Fe3+;紫色溶液中分离得到2.54g紫黑色固体为I2,因此可得溶液中![]() 分液后水层中加入足量NaOH溶液后,得到固体,则该固体为Fe(OH)3,则原溶液中一定含有Fe2+;固体洗涤、灼烧后得到1.60g固体,为Fe2O3,因此可得原溶液中
分液后水层中加入足量NaOH溶液后,得到固体,则该固体为Fe(OH)3,则原溶液中一定含有Fe2+;固体洗涤、灼烧后得到1.60g固体,为Fe2O3,因此可得原溶液中![]() ;根据电荷守恒可得,原溶液中一定含有Cl-,其物质的量最少为
;根据电荷守恒可得,原溶液中一定含有Cl-,其物质的量最少为![]() ;
;
A.由分析可知,溶液中一定含有Fe2+、I-和Cl-,A项正确;
B.由分析可知,溶液中一定含有Cl-, B项错误;
C.由分析可知,溶液中一定含有Fe2+,一定不含有Fe3+,C项错误;
D.由于溶液中可能含有Na+,因此溶液中所含n(Cl-)的最小量为0.03mol,其物质的量浓度![]() , D项错误;
, D项错误;
故答案为A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
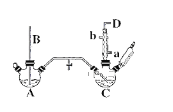
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。