题目内容
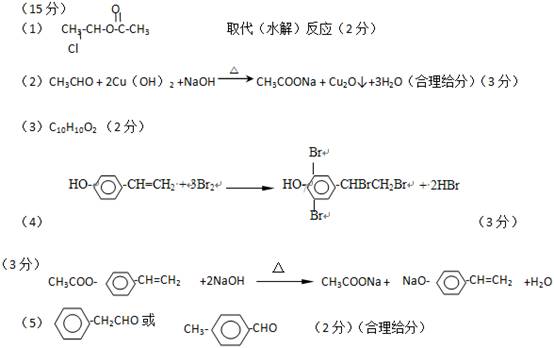
(1 5分)
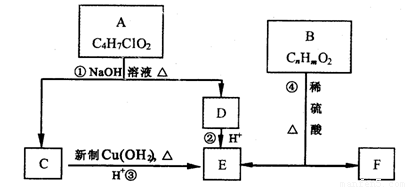
有机物A~F有如下转化关系:
已知一个碳原子上连有两个羟基时不稳定,转化如下:
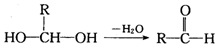
请回答:
(1)A的结构简式为: ;④的反应类型
(2)C与新制Cu(OH)2的化学方程式为
(3)已知B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,B的分子式为 。
(4)F是生产高分子光阻剂的主要原料,特点如下:
①能发生加聚反应 ②含有苯环且苯环上一氯取代物只有两种 ③遇FeCl3显紫色
F与浓溴水反应的化学方程式
B与NaOH反应的化学方程式
(5)F的一种同分异构体G含苯环且能发生银镜反应。写出一种满足条件的G的结构简式
【答案】
有机推断
【解析】本题综合考察了有机化学相关知识。在相关框图分析A结构中含有酯基和卤原子,①反应水解得到某种羧酸盐和含两个羟基的物质,同时根据给予的信息,同一个碳原子上的两个羟基失水得到一个醛基,这样就可以理解③反应的菲林反应。同时根据C能够转换成E,可知两分子中碳原子数相同,C为乙醛,D为乙酸。(3)中B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,所以分子式C10H10O2,且稀硫酸条件下水解,则F分子式C8H8O,其中含有一个-OH结构。

练习册系列答案
相关题目
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.

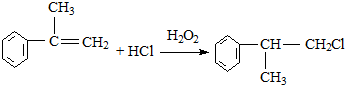







 的名称
的名称

