题目内容
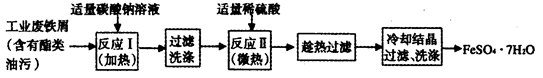
FeSO4·7H2O广泛用于医药和工业领域。
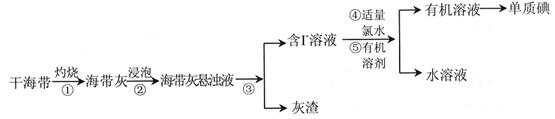
(1)下面是以工业废铁屑为原料生产FeSO4·7H2O的流程图。
请填写下列空白。
①加适量碳酸钠溶液的目的是______________,反应I需要加热数分钟,其原因是___________。
②判断反应Ⅱ完成的现象是__________。反应Ⅱ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及____________.
③测定FeSO4·7H2O产品中Fe2+含量的方法是用KMnO4溶液滴定法(5Fe2++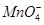 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取2.8500g FeSO4·7H2O产品,配制成250mL溶液;
Ⅱ.量取25.00mL待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000moL/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
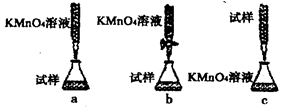
某同学设计如图所示的滴定方式中,最合理的是____________(夹持部分略去)(填字母序号);判断此滴定实验达到终点的方法是____________;计算上述样品中FeSO4·7H2O的质量分数为________(用小数表示,保留三位小数);若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;______________。
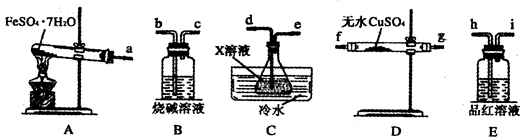
(2)已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O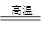 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
请填写下列空白。
①仪器的连接顺序为a接________、__________接_________、________接__________、__________接_____________。
②装置C中的X为______________;该装置中冷水的作用是_________________。
(1)下面是以工业废铁屑为原料生产FeSO4·7H2O的流程图。

请填写下列空白。
①加适量碳酸钠溶液的目的是______________,反应I需要加热数分钟,其原因是___________。
②判断反应Ⅱ完成的现象是__________。反应Ⅱ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及____________.
③测定FeSO4·7H2O产品中Fe2+含量的方法是用KMnO4溶液滴定法(5Fe2++
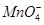 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:Ⅰ.称取2.8500g FeSO4·7H2O产品,配制成250mL溶液;
Ⅱ.量取25.00mL待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000moL/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。

某同学设计如图所示的滴定方式中,最合理的是____________(夹持部分略去)(填字母序号);判断此滴定实验达到终点的方法是____________;计算上述样品中FeSO4·7H2O的质量分数为________(用小数表示,保留三位小数);若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;______________。
(2)已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O
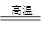 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
请填写下列空白。
①仪器的连接顺序为a接________、__________接_________、________接__________、__________接_____________。
②装置C中的X为______________;该装置中冷水的作用是_________________。
(15分)(1)①除油污(1分) 升温促进水解,溶液碱性增强,去油污能力增强(1分)
②固体不再溶解,固体表面不再有气泡产生(1分)
100ml容量瓶(2分)(只答容量瓶1分)
③b(1分) 滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色(1分)
0.975(2分) 样品中存在少量的杂质(1分) 样品部分被氧化(1分)
(2)①f、g、d、e、h、i、b(或g、f、d、e、h、i、b)(2分)
②BaCl2(1分) SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收(1分)
②固体不再溶解,固体表面不再有气泡产生(1分)
100ml容量瓶(2分)(只答容量瓶1分)
③b(1分) 滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色(1分)
0.975(2分) 样品中存在少量的杂质(1分) 样品部分被氧化(1分)
(2)①f、g、d、e、h、i、b(或g、f、d、e、h、i、b)(2分)
②BaCl2(1分) SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收(1分)
试题分析:(1)①由于工业废铁屑中含有酯类油污,所以必须除去酯类油污。碳酸钠溶液显碱性,可以溶解酯类油污达到去除的目的。由于升高温度促进水解,溶液碱性增强,去油污能力增强,所以反应I需要加热数分钟。
②反应Ⅱ是铁与稀硫酸的反应,生成物是硫酸亚铁和氢气,所以判断反应Ⅱ完成的现象是固体不再溶解,固体表面不再有气泡产生。配制一定物质的量浓度溶液时,所用的仪器除了有量筒、烧杯、玻璃棒、胶头滴管以外,还必须有100ml容量瓶。
③酸性高锰酸钾溶液应该放在酸式滴定管中,a中酸性高锰酸钾溶液放在碱式滴定管中,因此a不正确,b正确;硫酸亚铁溶液显酸性,应该放在酸式滴定管中,选项c不正确,答案选b。由于酸性高锰酸钾溶液显红色,所以该实验不需要指示剂。因此判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。根据方程式可知
5FeSO4·7H2O~KMnO4
5mol 1mol
n 0.01000moL/L×0.0200L
解得n=0.0010mol
所以上述样品中FeSO4·7H2O的质量分数为
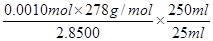 =0.975。
=0.975。由于硫酸亚铁极易被氧化,所以若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低,因此可能的原因是样品部分被氧化或样品中存在少量的杂质。
(2)①检验水蒸气一般用无水硫酸铜,检验SO2一般用品红溶液。由于SO2的熔沸点较低,因此SO3气体易被水吸收生成硫酸,可以通过检验硫酸来检验SO3。又因为通过溶液时必然带出水蒸气,所以首先检验水蒸气,其次检验SO3,最后检验SO2,且还要有尾气吸收装置,因此正确的顺序是a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)。
②检验硫酸的试剂可以是氯化钡溶液。又因为SO3与H2O的反应是放热反应,所以装置中冷水的作用是降低温度,便于SO3被水吸收。

练习册系列答案
相关题目