题目内容
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
(本题共12分)(1)过滤(1分);通入足量的Cl2(1分) BaCl2(1分)、K2CO3(1分);取样,滴加KSCN溶液,无明显现象(1分);
(2)NH3、CO2(共1分)NH3 + CO2 + H2O → NH4HCO3↓(1分)
KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出(1分)
(3)阴(1分);阴(1分) (4)4NO2 + O2 + 2H2O → 4HNO3(1分)能耗低(节能)(1分)
(2)NH3、CO2(共1分)NH3 + CO2 + H2O → NH4HCO3↓(1分)
KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出(1分)
(3)阴(1分);阴(1分) (4)4NO2 + O2 + 2H2O → 4HNO3(1分)能耗低(节能)(1分)
试题分析:(1)当沉淀完全后,需要通过过滤分离出沉淀;溴离子具有还原性,又因为不能引入新的杂质,所以可以通入足量氯气除去溴离子;氨水除去铁离子,SO42-应该有Ba2+除去,过量的Ba2+用碳酸钾除去,过滤后加入盐酸酸化即可除去过量的碳酸钾;铁离子检验一般用KSCN溶液,所以证明Fe3+已沉淀完全的操作是取样,滴加KSCN溶液,无明显现象。
(2)根据侯氏制碱法原理可知,应该向饱和KCl溶液中依次通入足量的氨气后CO2。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊,这说明该晶体一定不是碳酸氢钾,而是碳酸氢铵,因此生成碳酸氢铵的化学方程式是NH3+CO2+H2O→NH4HCO3↓。由于KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出,因此得不到碳酸氢钾,故而也得不到碳酸钾。
(3)惰性电极电解氯化钾溶液时,氯离子在阳极放电,生成氯气。阴极是氢离子放电生成氢气,同时破坏了阴极周围水的电离平衡,所以氢氧化钾在阴极区产生。由于阳极生成的氯气能和氢氧化钾反应生成氯化钾、次氯酸钾和水,所以要防止该副反应发生,应该阻止OH-向阳极移动,所以位于电解槽中间的离子交换膜应阻止阴离子通过。
(4)根据已知反应2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O、4KNO3 + 2H2O → 4KOH + 4NO2 + O2阳极总反应式4KCl + O2 + 2H2O → 4KOH + 2Cl2可知,硝酸和NO2是多余的,因此第⑤步反应应该是NO2生成硝酸的化合反应,即4NO2 + O2 + 2H2O → 4HNO3。因此与电解法相比,该方法的优势可能是能耗低(节能)。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目

 Al(OH)3+OH-。
Al(OH)3+OH-。

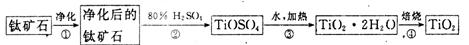
 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394 kJ/mol。
394 kJ/mol。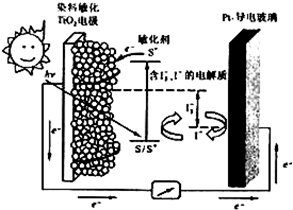
 TiO2/S*(激发态)
TiO2/S*(激发态) TiO2/S+ + e-
TiO2/S+ + e-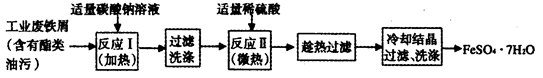
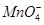 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为: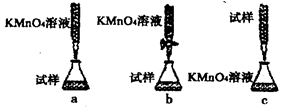
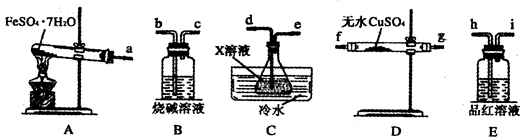
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。