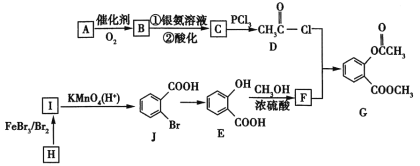
题目内容
【题目】SPC(2Na2CO33H2O2)具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO410H2O)、H2O2等为原料制备SPC的工艺流程如下:
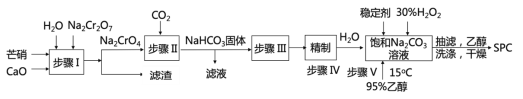
回答下列问题:
(1)步骤I产生的滤渣为__________________(填名称)。
(2)步骤II中发生反应的离子方程式为_________________。其中生成的__________(填化学式)可以循环使用。
(3)步骤V中,合成时需选择温度为15℃,其原因是_____________________。
(4)抽滤后用乙醇洗涤的作用是_______________________________________。
(5)SPC的保存方法是______________________________。
(6)过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600 g样品,置于250 mL锥形瓶中,并用100 mL 0.5 molL-1硫酸溶解完全,立即用0.02000molL-1KMnO4标准溶液滴定,滴定至终点时溶液颜色为_____,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。该样品的活性氧含量为______%。
【答案】硫酸钙或石膏 2Na+ + 2CrO42-+2CO2 + H2O=Cr2O72- + 2NaHCO3↓ Na2Cr2O7 温度低于15℃,反应速率慢,温度高于15℃,过氧化氢受热易分解(或产品受热易分解,答15℃利于产品结晶析出不给分不扣分) 除去SPC晶体表面的水分,使其快速干燥 低温、避光、密封保存 浅红色 12.16
【解析】
Na2SO4·10H2O、重铬酸钠、氧化钙反应生成铬酸钠、硫酸钙,铬酸钠、二氧化碳和水反应生成重铬酸钠和碳酸氢钠,过滤得到碳酸氢钠,碳酸氢钠分解生成碳酸钠,碳酸钠饱和溶液与双氧水反应得到SPC,用95%乙醇洗涤,再抽滤、干燥得到SPC。
(1)根据分析得到步骤I产生的滤渣为硫酸钙;故答案为:硫酸钙或石膏。
(2)步骤II中铬酸钠、二氧化碳和水反应生成重铬酸钠和碳酸氢钠,Na2Cr2O7可以循环使用,因此发生的离子方程式为2Na+ + 2CrO42-+2CO2 + H2O=Cr2O72- + 2NaHCO3↓。
(3)步骤V中,温度较低,反应速率较慢,反应温度较高,双氧水易分解,也有可能产品易分解,因此合成时需选择温度为15℃;故答案为:温度低于15℃,反应速率慢,温度高于15℃,过氧化氢受热易分解。
(4)抽滤后产品表面有水分,用乙醇除掉水分以便快速干燥;故答案为:除去SPC晶体表面的水分,使其快速干燥。
(5)由于SPC易分解,因此SPC的保存方法是低温、避光、密封保存;故答案为:低温、避光、密封保存。
(6)用KMnO4标准溶液滴定,滴定至终点时为KMnO4溶液的颜色,即溶液颜色为浅红色,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL,则活性氧消耗的KMnO4溶液的平均体积为26.56mL-2.24 mL = 24.32mL,根据活性氧与高锰酸钾的关系式即2KMnO4~5H2O2,即样品中活性氧物质的量为![]() ,则样品中活性氧含量为
,则样品中活性氧含量为![]() ;故答案为:紫红色;12.16%。
;故答案为:紫红色;12.16%。