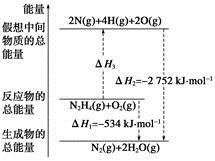
题目内容
设NA代表阿伏伽德罗常数的值,则关于反应:C2H2 (g) + 5/2O2(g)=2CO2(g) + H2O(l) △H=-1300 kJ?mol-1的热化学方程式的说法中正确的是
| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
AD
解析试题分析:A、每有1 mol C2H2参加反应,转移10 mol电子,放出1 300 kJ能量,故A正确;B、由热化学方程式看出,该反应为放热反应,故B错误;C、1 mol CO2分子中含有4 mol碳氧共用电子对,有8NA个碳氧共用电子对生成时,即生成了2 mol CO2,放出1 300 kJ的能量,故C错误;D、1 mol CO2分子中含有4 mol碳氧共用电子对,有8NA个碳氧共用电子对生成时,即生成了2 mol CO2,放出1 300 kJ的能量,故D正确,故选AD。
考点:考查热化学方程式计算应用

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是
| A.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| B.火电是将燃料中的化学能直接转化为电能的过程 |
| C.将煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D.化学反应的限度不可以通过改变条件而改变 |
下列有关能量的说法不正确的是 ( )
| A.化石能源物质内部贮存着大量的能量 |
| B.植物的光合作用使太阳能转化为化学能 |
| C.燃料燃烧时只是将化学能转化为热能 |
| D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低 |
下列说法中不正确的是( )
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.吸热反应需要加热后才能发生 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
下列化学反应属于吸热反应的是
| A.碘的升华 | B.生石灰溶于水 |
| C.镁与稀盐酸反应 | D.熟石灰与NH4Cl晶体混合制氨 |
关于吸热反应的说法,正确的是
| A.凡需加热的反应一定是吸热反应 |
| B.只有分解反应才是吸热反应 |
| C.使用催化剂的反应是吸热反应 |
| D.酸碱中和反应的逆反应是吸热反应 |
下列反应属于放热反应的是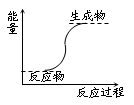
| A.氢氧化钡晶体和氯化铵晶体的反应 |
| B.能量变化如图所示的反应 |
| C.化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D.燃烧反应和中和反应 |
下列说法正确的是( )
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的 ΔH =" —40.69" kJ·mol-1 H2O(l) 的 ΔH =" —40.69" kJ·mol-1 |
| B.在25℃、101kPa,2mol S的燃烧热是1mol S的燃烧热2倍 |
| C.CH4(g) +2O2(g) =CO2(g) +2H2O(g) ΔH=-akJ·mol-1,这里ΔH代表燃烧热 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应
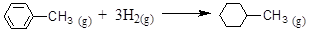 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1