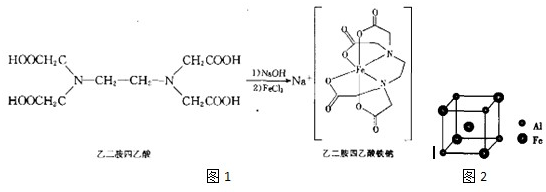
题目内容
13.下列说法正确的是( )| A. | 氧化钠、氧化铁、氧化镁均为碱性氧化物 | |
| B. | 离子键、共价键、金属键、氢键均为化学键 | |
| C. | 氨水、水玻璃、水银、聚乙烯均为混合物 | |
| D. | 水能、风能、生物质能、核能均为可再生能源 |
分析 A、碱性氧化物是指能和酸反应生成盐和水的化合物;
B、根据化学键的类别来回答;
C、由不同物质组成的物质是混合物;
D、能够源源不断的从自然界得到补充的能源叫可再生能源.
解答 解:A、氧化钠、氧化铁、氧化镁均能和酸反应生成盐和水,为碱性氧化物,故A正确;
B、化学键包括离子键和共价键、金属键,氢键为分子之间的作用力,不属于化学键,故B错误;
C、氨水、水玻璃、聚乙烯均为混合物,水银属于单质,故C错误;
D、常见的可再生能源有太阳能、风能、地热能、生物质能,核能不是可再生能源,故D错误.
故选A.
点评 本题涉及物质的分类、化学键的分类、混合物的概念以及能源的分类知识,属于综合知识的考查,难度中等.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
8. 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )| A. | 该储氢装置的电流效率η=64.3% | |
| B. | D电极室发生的所有的电极反应为:C4H6+6H++6e-═C6H12 | |
| C. | B电极为电源的负极 | |
| D. | H+由D电极室移向E电极室 |
18.水的电离平衡曲线如如图所示,下列说法不正确的是( )
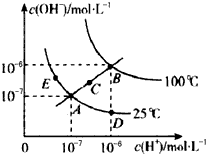

| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | 若从A点到D点,可采用在水中加入少量酸的方法 | |
| C. | 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体 | |
| D. | 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性 |
5.下列物质属于离子化合物的是( )
| A. | NaF | B. | H2O | C. | HBr | D. | CH4 |
2.X、Y、Z是短周期是三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为17,原子序数之和为39,则X、Y、Z的元素符号为( )
| A. | Na、K、Ca | B. | N、P、S | C. | O、S、P | D. | F、Cl、S |
3.将一块银白色的金属钠放在空气中会发生一系列的变化,表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述正确的是( )
| A. | 表面迅速变暗是因为生成了过氧化钠 | |
| B. | “出汗”是因为NaOH 具有吸湿性 | |
| C. | 从“出汗”→变成白色固体(粉末)的过程中只发生了物理变化 | |
| D. | 最后得到的白色固体是NaOH |
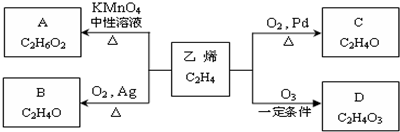
 DCH3COOOH
DCH3COOOH .
.