题目内容
(10分)已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42- (aq)
I3-(aq)+2SO42- (aq)
(1)写出反应的平衡常数表达式K= ;
(2)右图表示反应过程中有关物质的能量,则反应的 0(填“>”、“<”或“=”);
0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是 线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 ;
(4)反应的速率可以用 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
c( )/mol·L-1 )/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
(10分)
(1)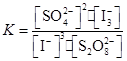 (2分) (2)<(1分),(Ⅱ)(1分) (3)3∶2(2分)
(2分) (2)<(1分),(Ⅱ)(1分) (3)3∶2(2分)
(4)研究 、
、 浓度对反应速率的影响(1分);22(1分);反应速率与反应物浓度乘积成正比(2分)。
浓度对反应速率的影响(1分);22(1分);反应速率与反应物浓度乘积成正比(2分)。
解析试题分析:(1)平衡常数是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,即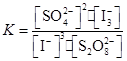
(2)生成物的总能量低于反应物的总能量,故为放热反应, <0;催化剂可以降低反应的活化能,故第II条线为加了催化剂的
<0;催化剂可以降低反应的活化能,故第II条线为加了催化剂的
(3)由反应3I-(aq)+S2O82-(aq)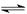 I3-(aq)+2SO42- (aq)中元素化合价的升降可看出,S2O82-中硫元素+7价,产物离子SO42-中硫为+6价,两个硫原子共降低两价,而三个I—必定有两个由—1价升至0价,所以发生反应的I-与被氧化的I-的物质的量比为3:2
I3-(aq)+2SO42- (aq)中元素化合价的升降可看出,S2O82-中硫元素+7价,产物离子SO42-中硫为+6价,两个硫原子共降低两价,而三个I—必定有两个由—1价升至0价,所以发生反应的I-与被氧化的I-的物质的量比为3:2
(4)由表格数据可看出,通过改变 、
、 浓度改变反应速率,故该实验的目的是研究
浓度改变反应速率,故该实验的目的是研究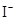 、
、 浓度对反应速率的影响;
浓度对反应速率的影响;
通过比较各组数据可得出:反应速率与反应物浓度乘积成正比,故第⑤组数据所对应的反应时间与第③组的相同,即t1=22s
考点:化学平衡常数、反应与能量的变化、氧化还原反应、实验数据处理
点评:本题对基本概念及化学反应原理进行了综合考查,虽涉及的知识点较多,但难度一般。

I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
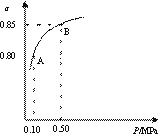 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气

 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394
kJ/mol。
394
kJ/mol。
 TiO2/S*
(激发态)
TiO2/S*
(激发态) TiO2/S+
+ e-
TiO2/S+
+ e-