题目内容
某化合物的化学式可表示为Co(NH3)xCly(x、y均为正整数)。为确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在条件下用AgNO3溶液滴定(生成AgCl沉淀),共消耗含0.4080gAgNO3的溶液。在另一份试样中加入过量的NaOH溶液并加热,用足量盐酸吸收逸出的NH3,吸收NH3共消耗含0.1752gHCl的溶液。试通过计算确定该化合物的化学式。见解析
【试题分析】
很显然,要把题目中发生反应的化学方程式写出来有一定难度,所以不可能依据化学方程式来进行计算。但如果通过离子方程式来计算却显得方便得多。解题过程可简单表述如下:
设含Cl-为x,含NH3为y,则:
Ag+ + Cl- = AgCl↓
108 35.5
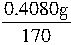 ×108 x
×108 x解之得:x=0.0852g
NH3 + HCl = NH4Cl
17 36.5
y 0.1752g
解之得:y=0.0816g
m(钴离子)=0.2140g-0.0852g-
0.0816g=0.0472g
所以N(钴离子): N(NH3)∶N(Cl-)=
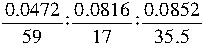 =1∶6∶3
=1∶6∶3所以该化合物的化学式为Co(NH3)6Cl3。

(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。

(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为 ;该元素还可与元素①形成10电子的气体分子Y ,将过量的Y气体通入盛有硝酸银水溶液的试管里,发生化学反应所对应的离子方程式为
。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
|
电离能I(eV) |
A |
B |
C |
D |
E |
F |
|
I1[来源:学&科&网] |
11.3 |
14.5 |
13.6 |
5.2 |
7.6 |
6.0 |
|
I2 |
24.4 |
29.6 |
35.1 |
49.3 |
15.0 |
18.8 |
|
I3 |
47.9 |
47.4 |
54.9 |
71.6 |
80.1 |
28.4 |
|
I4 |
64.5 |
77.5 |
77.4 |
98.9 |
109.2 |
112.0 |
|
I5 |
392.1 |
97.9 |
113.9 |
138.3 |
141.3 |
153.7 |
请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是 。




