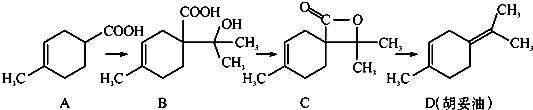
题目内容
【题目】25℃时,将agNH3完全溶于水,得到VmLpH=8的氨水,假设该氨水密度为ρg·cm3,溶质的质量分数为ω,其中含NH4+的物质的量为bmol,下列叙述中一定正确的是
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为ω=![]() ×100%
×100%
C. c(OH-)=(![]() +10-8)mol·L-1
+10-8)mol·L-1
D. 为使溶液的质量分数等于0.5ω,应加入VmL水
【答案】C
【解析】A.a g NH3的物质的量为![]() =
=![]() mol,溶液体积为VmL,所以溶液的物质的量浓度为
mol,溶液体积为VmL,所以溶液的物质的量浓度为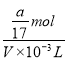 =
=![]() mol/L,故A错误;B.氨水溶液溶质为氨气,该溶液的密度为ρ gcm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为
mol/L,故A错误;B.氨水溶液溶质为氨气,该溶液的密度为ρ gcm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为![]() ×100%=
×100%=![]() ×100%,故B错误;C.溶液的pH=8,即c(H+)=10-8mol/L,溶液中存在电荷守恒,则c(NH4+)+c(H+)=c(OH-),因此c(OH-)=
×100%,故B错误;C.溶液的pH=8,即c(H+)=10-8mol/L,溶液中存在电荷守恒,则c(NH4+)+c(H+)=c(OH-),因此c(OH-)= ![]() +10-8mol/L=(
+10-8mol/L=(![]() +10-8)mol/L,故C正确;D.水的密度比氨水的密度大,若加入相等体积的水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误;故选C。
+10-8)mol/L,故C正确;D.水的密度比氨水的密度大,若加入相等体积的水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误;故选C。

练习册系列答案
相关题目