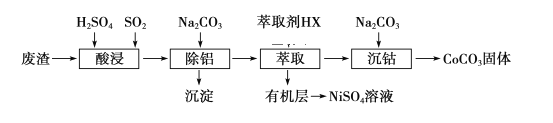
题目内容
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=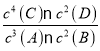
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
【答案】D
【解析】
恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,利用三段式法计算出反应后气体物质的量,确定C、D的状态,据此进行解答。
反应方程式为:3A(g)+2B(g) ![]() 4C(?)+2D(?),在反应前n(A)=4mol,n(B)=2mol,n(C)=n(D)=0,由于平衡后生成C的物质的量是1.6mol,则根据物质转化的物质的量关系可知会同时生成D的物质的量是0.8mol,则此时A的物质的量为4mol-
4C(?)+2D(?),在反应前n(A)=4mol,n(B)=2mol,n(C)=n(D)=0,由于平衡后生成C的物质的量是1.6mol,则根据物质转化的物质的量关系可知会同时生成D的物质的量是0.8mol,则此时A的物质的量为4mol-![]() ×1.6mol=2.8mol,B的物质的量是2mol-0.8mol=1.2mol,由气体物质的量之比等于压强之比可得反应后达到平衡时气体物质的量为n(平衡)=
×1.6mol=2.8mol,B的物质的量是2mol-0.8mol=1.2mol,由气体物质的量之比等于压强之比可得反应后达到平衡时气体物质的量为n(平衡)=![]() ×(4+2)mol=4.8mol,所以D为气体、C不是气体。
×(4+2)mol=4.8mol,所以D为气体、C不是气体。
A.由于C的状态不是气体,则平衡常数表达式中C不能出现在表达式中,A错误;
B.达到平衡时B转化的物质的量为0.8mol,则B的转化率为![]() =40%,B错误;
=40%,B错误;
C.化学平衡常数只受温度影响,增大压强后温度不变,则化学平衡常数不变,C错误;
D.由于C不是气体,增大C的量,化学平衡不移动,B的平衡转化率不变,D正确;
故合理选项是D。

【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=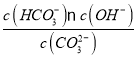 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“span>不变”)。