题目内容
 现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.为了确定该酸溶液的组成进行实验:取25.00mL0.1mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50mL.请回答:
(1)该酸不可能是
硫酸
硫酸
;(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为
醋酸
醋酸
,用离子方程式说明溶液呈碱性的原因CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
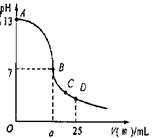
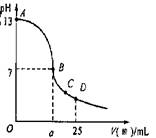
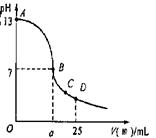
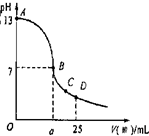
;(3)实验中滴定曲线如图,在B点,a
大于
大于
12.5(填大于、小于或等于)在C点各离子浓度由大到小排序
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.分析:(1)根据酸和碱的物质的量之比来判断;
(2)根据强碱弱酸盐,弱酸的酸根离子水解,溶液呈碱性来分析出;
(3)B点醋酸应过量,结合溶液中存在醋酸钠、醋酸及电离平衡和水解平衡来解答.
(2)根据强碱弱酸盐,弱酸的酸根离子水解,溶液呈碱性来分析出;
(3)B点醋酸应过量,结合溶液中存在醋酸钠、醋酸及电离平衡和水解平衡来解答.
解答:解:(1)某酸溶液物质的量为0.2mol/L×12.50mL,氢氧化钠溶液的物质的量25.00mL×0.1mol/L,酸和碱的物质的量之比1:1,所以酸为一元酸,不可能为硫酸,
故答案为:硫酸;
(2)醋酸与氢氧化钠反应生成醋酸钠,醋酸根离子水解:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:醋酸;CH3COO-+H2O?CH3COOH+OH-;
(3)醋酸和氢氧化钠恰好反应时,溶液呈碱性,要使溶液的pH=7,则酸应过量,即a大于12.5,在C点时溶液中存在醋酸钠、醋酸,溶液呈酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:大于;c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
故答案为:硫酸;
(2)醋酸与氢氧化钠反应生成醋酸钠,醋酸根离子水解:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:醋酸;CH3COO-+H2O?CH3COOH+OH-;
(3)醋酸和氢氧化钠恰好反应时,溶液呈碱性,要使溶液的pH=7,则酸应过量,即a大于12.5,在C点时溶液中存在醋酸钠、醋酸,溶液呈酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:大于;c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评:本题主要考查了酸碱中和、盐类水解和溶液中离子浓度的比较,难度中等,根据所学知识即可完成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目