题目内容
(14分)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。

①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 。
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。

①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
(14分)
(1)硫酸(2分)
(2)①Cu2+ + 2e-== Cu(2分),乙(2分)
Cu(2分),乙(2分)
②O2,CH4-8e-+10OH-=CO32-+7H2 O,0.28L(各2分,共6分)
O,0.28L(各2分,共6分)
(3)AD(2分)
(1)硫酸(2分)
(2)①Cu2+ + 2e-==
 Cu(2分),乙(2分)
Cu(2分),乙(2分)②O2,CH4-8e-+10OH-=CO32-+7H2
 O,0.28L(各2分,共6分)
O,0.28L(各2分,共6分)(3)AD(2分)
略

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
 。
。
 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极, (3)乙池中发生反应的离子方程式为 ;
(3)乙池中发生反应的离子方程式为 ;
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。 熔点、沸点数据如下:
熔点、沸点数据如下:
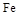
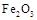
 62
62 750
750 。
。 试剂中最适宜的试剂是
试剂中最适宜的试剂是  ”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知: 与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为__________,该反应的热化学方程式
与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为__________,该反应的热化学方程式 为 。
为 。