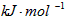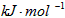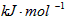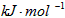题目内容
火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知
N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ/mol
N2H4(g) +O2(g) =N2(g) + 2H2O (g) △H = -534 kJ/mol
则N2H4和NO2反应的热化学方程式为_____________________________
N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ/mol
N2H4(g) +O2(g) =N2(g) + 2H2O (g) △H = -534 kJ/mol
则N2H4和NO2反应的热化学方程式为_____________________________
N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g) △H=-567.85kJ/mol

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O 
 则1mol C与反应生成CO的反应热△H为
则1mol C与反应生成CO的反应热△H为