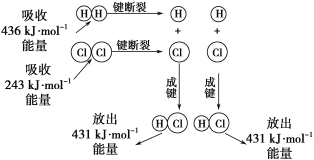
题目内容
【题目】如图是温度和压强对X+3Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
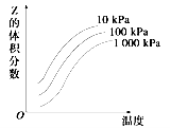
A.上述反应的正反应ΔH>0
B.升高温度,化学平衡常数K减小
C.X、Y、Z均为气态
D.当Y的浓度不再发生变化时,该反应达到平衡状态
【答案】A
【解析】
试题分析:A、压强相同时升高温度Z的体积分数增大,说明升高温度平衡向正反应方向进行,所以正反应ΔH>0,A正确;B、升高温度平衡向正反应方向进行,平衡常数增大,B错误;C、当温度相同时,增大压强,Z的体积分数减小,说明增大压强平衡向逆反应方向进行,所以正反应是体积增大的可逆反应,则Z一定是气体,Y一定不是气态,C错误;D、Y不是气态,当Y的浓度不再发生变化时,不能说明反应达到平衡状态,D错误,答案选A。

【题目】在体积恒定为3L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)上述反应涉及三种元素,其中原子半径最大的元素核外电子排布式为_________,原子核外电子运动状态最多的元素是_______(写元素符号)。
(2)上述反应所涉及的四种物质中非极性分子的沸点顺序是_____,其主要原因是_________。
(3)该反应的化学平衡常数表达式为_______;该反应的正方向是________反应(选填“吸热”、放热)
(4)某温度下,2min内生成10.8g H2O(g),用CO浓度变化表示这段时间内的平均反应速率为____________;若平衡时各物质浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为_________℃
(5)能判断该反应是否达到化学平衡状态的依据是_______
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
【题目】某校化学兴趣小组根据反应:H2O2+2HI=2H2O+I2探究影响化学反应速率的因素。实验数据如下:
实验 编号 | H2O2溶液浓度/(mol·L-1) | HI溶液浓度/(mol·L-1) | 温度/℃ | 反应速率/(mol·L-1·s-1) |
① | 0.1 | 0.1 | 25 | 0.0076 |
② | 0.1 | 0.2 | 25 | 0.0153 |
③ | 0.1 | 0.3 | 25 | 0.0227 |
④ | 0.1 | 0.1 | 35 | 0.0304 |
回答下列问题:
(1)反应:H2O2+2HI=2H2O+I2中,氧化剂是___。
(2)25℃时,表明增大反应物浓度,化学反应速率___(填“增大”或“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和___。
(4)H2O2不稳定,写出H2O2发生分解反应的化学方程式:___。