题目内容
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现将1.92gCu放入足量稀硫酸中,若要使铜完全溶解,理论上至少应加入NaNO3的物质的量为( )
| A.0.080 mol | B.0.060 mol | C.0.045 mol | D.0.020 mol |
D
发生反应为3Cu2++8H++2NO3-=3Cu2++4H2O+2NO↑
Cu的物质的量为0.03mol ,需NO3-物质的量为0.02mol ,即应加入NaNO3的物质的量为0.020 mol
Cu的物质的量为0.03mol ,需NO3-物质的量为0.02mol ,即应加入NaNO3的物质的量为0.020 mol

练习册系列答案
相关题目
 Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。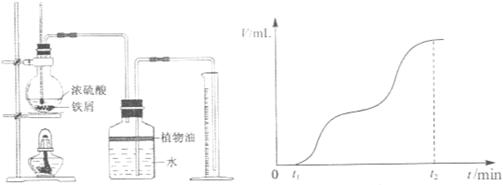
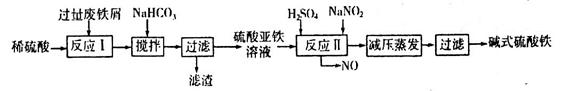
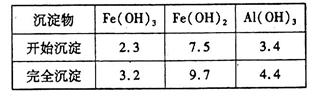
 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。