题目内容
某元素的同位素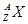 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有20个中子,求:
(1)A=
(2)X元素在周期表中的位置? ,XCl2的化学式: 。
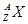 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有20个中子,求:
(1)A=
(2)X元素在周期表中的位置? ,XCl2的化学式: 。
(3分 )(1)40;(2)第四周期第IIA主族;CaCl2
试题分析:(1)硝酸银的物质的量是2mol/L×0.02L=0.04mol
则根据方程式Ag++Cl-=AgCl↓可知
氯化物中氯离子的物质的量是0.04mol
则该氯化物的物质的量是0.02mol
则

解得A=40
(2)Z=40-20=20
因此X是Ca,位于第四周期第ⅡA族
该氯化物的化学式是CaCl2
点评:该题是基础性试题的考查,难度不大。试题注重基础知识的巩固和解题方法的指导,有利于培养学生的逻辑思维能力和规范答题能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素。
质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素。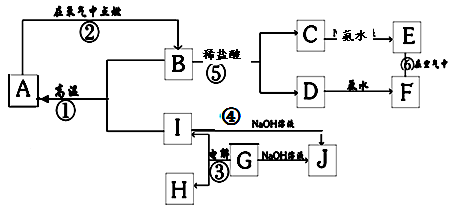
 (A+N+m)mol
(A+N+m)mol  (A-N)mol
(A-N)mol
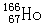 可有效治疗肝癌。该核素原子核内的中子数为
可有效治疗肝癌。该核素原子核内的中子数为

 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是  提高C的转化率
提高C的转化率