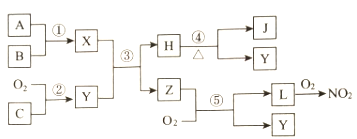
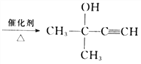
题目内容
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___;
(2)A与B的平衡转化率之比为___;
(3)反应过程中容器内气体的平均相对分子质量变化是___(填“增大”、“减小”或“不变”,下同),气体的密度变化是___;
(4)一定能说明上述反应已经达到化学平衡状态的是___。
a.容器内气体压强不再改变
b.2v(A)=3v(C)
c.A的浓度不再改变
d.A、B、C、D的分子数之比为3∶1∶2∶2
e.反应停止,不再继续进行
【答案】0.04mol·L-1·s-1 1∶1 不变 不变 c
【解析】
设A、B起始物质物质的量为a、b,则: ,据此分析解答。
,据此分析解答。
(1)C的物质的量变化量=0.8mol,则C的物质的量浓度变化量=![]() =0.4 mol·L-1,所以用C表示10s内反应的平均反应速率=
=0.4 mol·L-1,所以用C表示10s内反应的平均反应速率=![]() =0.04 mol·L-1·s-1,故答案为:0.04 mol·L-1·s-1;
=0.04 mol·L-1·s-1,故答案为:0.04 mol·L-1·s-1;
(2)由分析可知,A、B起始物质的量为a=1.8mol+1.2mol=3mol、b=0.6mol+0.4mol=1mol,所以,A与B的平衡转化率之比=![]() :
:![]() =1∶1,故答案为:1∶1;
=1∶1,故答案为:1∶1;
(3)该反应的所有反应物和生成物均是气体,气体总质量不变,同时,该反应是个气体物质的量不变的反应,由![]() 可知,n、m不变,则M不变,即反应过程中容器内气体的平均相对分子质量不变。由
可知,n、m不变,则M不变,即反应过程中容器内气体的平均相对分子质量不变。由![]() 可知,m、V不变,则
可知,m、V不变,则![]() 不变,即反应过程中容器内气体的密度不变,故答案为:不变;不变;
不变,即反应过程中容器内气体的密度不变,故答案为:不变;不变;
(4)a.该反应是气体分子数不变的反应,任何时刻气体总压都不变,a不能说明是否已平衡;
b.没有指明是逆反应速率还是正反应速率,b不能说明是否已平衡;
c.容器体积始终为2L,A的浓度不再改变,说明A的物质的量不再改变,c说明已达平衡;
d.A、B、C、D的分子数之比为3∶1∶2∶2不代表它们的分子数不再改变,d不能说明是否已平衡;
e.平衡时反应并没有停止,是动态平衡,e不能说明是否已平衡;
综上所述,c能说明已平衡,故答案为:c。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1
C.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
Cl2(g)=HCl(g) ΔH=+91.5kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ·mol-1