��Ŀ����
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش�
![]() ��1����һ������ĺ����ܱ������У��������»�ѧ��Ӧ�� N2(g)+3H2(g) 2NH3(g)
��1����һ������ĺ����ܱ������У��������»�ѧ��Ӧ�� N2(g)+3H2(g) 2NH3(g)
�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/K | 298 | 398 | 498 | �� |
| K/(mol��L��1)2 | 4.1��106 | K1 | K2 | �� |
����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1 K2���>������=����<������
���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ������ţ���
A��2v(H2)������=3v(NH3)���棩 B��v(N2)������=3v(H2)���棩C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��2�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�
��д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ ��
��������ˮ��Һ������Ũ�ȵ�����˳����ȷ���� ������ţ���
A��c(Cl��)>c(N2H62+)>c(H+)>c(OH��)
B��c(Cl��)>c([N2H5��H2O+])> c(H+)>c(OH��)
C��c(N2H62+)+c([N2H5��H2O+])+c(H+)= c(Cl��)+c(OH��)
D��c(N2H62+)>c(Cl��)>c(H+)>c(OH��)
��ˮ�����ؽ���Ǧ����Ⱦ���ⱸ�ܹ�ע�������ϵ�֪Pb4+���к�ǿ�������ԡ�ˮ��Ǧ�Ĵ�����̬��Ҫ��Pb2+��Pb(OH)+��Pb(OH)2����ˮ���ܽ��С����Pb(OH)3����Pb(OH)42��������̬�����ʵ����ķ���������ҺpH�仯�Ĺ�ϵ����ͼ��ʾ��
��1��Pb(NO3)2��Һ�У�c(Pb2+)/c(NO3��) 1/2�����������=��������������
��2����Pb(NO3)2��Һ�μ����ᣬ��Һ��c(Pb2+)/c(NO3��)û�б������С���г������ɣ������ɵij�������Ϊ ��
��3����Pb(NO3)2��Һ�еμ�NaOH��Һ����ҺҲ����ǣ���pHԼΪ ʱ���ɳ�����࣬�����μ�NaOH��Һ�������ϵ������塣pH = 13ʱ�������ϵ�з�������Ҫ��Ӧ�����ӷ���ʽΪ�� ��
��1���٣���2�֣� ��AC��2�֣�
��2���� N2H62++H2O [N2H5��H2O]+ + H+��2�֣� ��A��2�֣�
��< ��2�֣�
��PbCl2��2�֣�
��10��2�֣�
Pb(OH)3�� + OH�� = Pb(OH)42����2�֣�
����:��

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д� ���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�
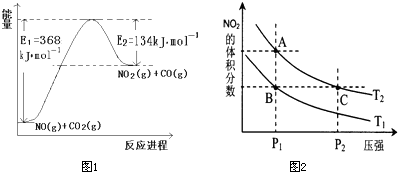
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�