题目内容
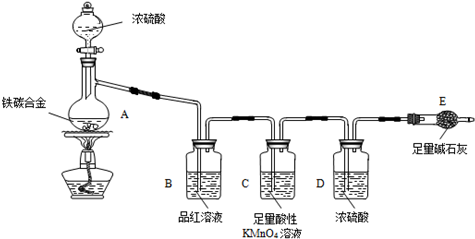
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定
铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹
持仪器已省略)和实验方案进行实验探究。
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连
上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,
待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,
原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是___________________________________________________________。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁
的质量分数也可能会偏高。你认为其中的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:_______________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
(1)把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管产生一段水柱(后一现象可不写出)(2分);
(2)×100%(2分);
(3)除去CO2中的SO2(2分);
(4)在装置E的后边再连接一个与E相同的装置。(2分)
(5)反应产生的CO2气体未能完全排到装置E中,导致b偏低。(2分)
(6)常温下,Fe被浓H2SO4钝化,碳不与浓H2SO4反应(2分);
(7)2Fe + 6H2SO4(浓)Fe2(SO4)3 +3SO2↑ + 6H2O(2分);
解析:略