题目内容
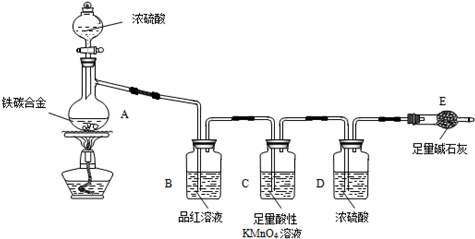
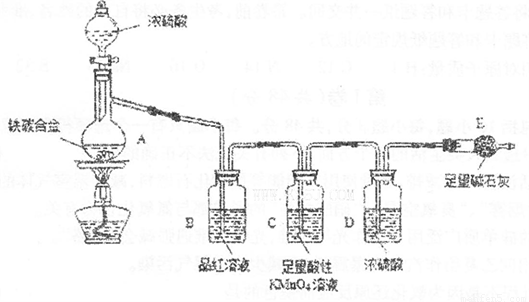
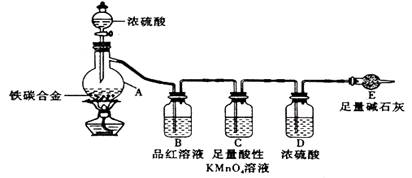
现有某铁碳合金(铁和碳两种单质的混合物),k某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
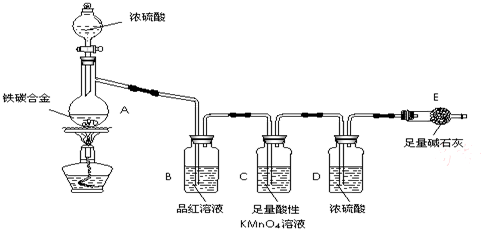
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后 ,则证明装置的气密性良好.
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是: .
(3)A中铁与浓硫酸发生反应的化学方程式是 ,
(4)装置C的作用 .
(5)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为 (写表达式).
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是 .
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高.你认为其中的原因是 .

(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
(3)A中铁与浓硫酸发生反应的化学方程式是
(4)装置C的作用
(5)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高.你认为其中的原因是
分析:(1)依据装置中的压强变化恒容液面变化分析检验,最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱;
(2)常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
(3)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水;
(4)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫;
(5)根据mg铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
(6)E装置后再连接一个盛碱石灰的干燥管防止空气中的二氧化碳、水蒸气进入干燥管;
(7)装置中生成的二氧化碳不能全部被碱石灰吸收.
(2)常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
(3)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水;
(4)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫;
(5)根据mg铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
(6)E装置后再连接一个盛碱石灰的干燥管防止空气中的二氧化碳、水蒸气进入干燥管;
(7)装置中生成的二氧化碳不能全部被碱石灰吸收.
解答:解:(1)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
故答案为:将导气管插入水中,加热烧瓶,导气管冒气泡,停止加热有一段水柱上升;
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,故无明显现象;
(3)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;
故答案为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;
(4)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ;
故答案为:吸收除去二氧化硫;
(5)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
=
g,则含铁的质量为mg-
g,铁的质量分数为
×100%;
故答案为:
×100%;
(6)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
故答案为:E装置后再连接一个盛碱石灰的干燥管;
(7)装置中生成的二氧化碳不能全部被碱石灰吸收会导致测定结果偏低,故答案为:反应产生的CO2气体未能完全排到装置E中,导致b偏低.
故答案为:将导气管插入水中,加热烧瓶,导气管冒气泡,停止加热有一段水柱上升;
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,故无明显现象;
(3)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓)
| ||
故答案为:2Fe+6H2SO4(浓)
| ||
(4)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ;
故答案为:吸收除去二氧化硫;
(5)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
| 12b |
| 44 |
| 3b |
| 11 |
| 3b |
| 11 |
| 11m-3b |
| 11m |
故答案为:
| 11m-3b |
| 11m |
(6)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
故答案为:E装置后再连接一个盛碱石灰的干燥管;
(7)装置中生成的二氧化碳不能全部被碱石灰吸收会导致测定结果偏低,故答案为:反应产生的CO2气体未能完全排到装置E中,导致b偏低.
点评:本题考查了物质性质的探究实验方法,装置的特征分析,流程反应和试剂作用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目