题目内容
17.下列有关实验装置进行的相应实验,能达到实验目的是( )| A. |  可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 | |
| B. | 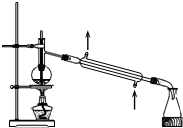 可分离石油,得到汽油、煤油和柴油等各种馏分 可分离石油,得到汽油、煤油和柴油等各种馏分 | |
| C. | 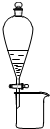 利用此图分离CH3CH2OH和CH3COOC2H5混合液 利用此图分离CH3CH2OH和CH3COOC2H5混合液 | |
| D. | 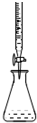 可进行酸碱中和滴定 可进行酸碱中和滴定 |
分析 A.氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和HCl,升高温度促进盐酸挥发,所以蒸干氯化铁溶液时得到氢氧化铁固体;
B.蒸馏时温度计测量馏分温度;
C.互溶的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离;
D.酸碱中和滴定常用到滴定管和锥形瓶等仪器.
解答 解:A.氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和HCl,升高温度促进盐酸挥发,所以蒸干氯化铁溶液时得到氢氧化铁固体,所以不能采用直接蒸干的方法制备氯化铁晶体,故A错误;
B.蒸馏时温度计测量馏分温度,所以温度计水银球应该位于烧瓶支管口处,故B错误;
C.互溶的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离,二者互溶,应该采用蒸馏方法分离,故C错误;
D.酸碱中和滴定常用到滴定管和锥形瓶等仪器,图为中和滴定操作,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的制备、分离以及中和滴定等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质异同以及实验的严密性、可行性的评价,易错选项是A.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | △H<0,△S>0所有温度下反应能自发进行 | |
| B. | △G=△H-T△S>0 反应能自发进行 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发性的 | |
| D. | 自发反应一定不需要任何条件就容易发生 |
9.下列有关化学用语使用正确的是( )
| A. | CO2分子比例模型: | |
| B. | NaHCO3的电离方程式NaHCO3═Na++HCO3- | |
| C. | 羟基的电子式: | |
| D. | ( CH3)2CHCH(OH)CH3的名称:2-甲基-3-丁醇 |
6.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法不正确的是( )
| A. | 该反应中的还原剂是S2O32- | |
| B. | H2O参与该反应,且作氧化剂 | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |

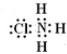 .
.