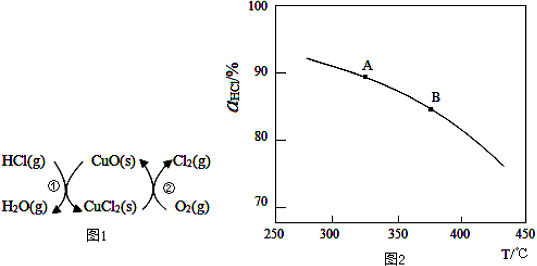
题目内容
6.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法不正确的是( )| A. | 该反应中的还原剂是S2O32- | |
| B. | H2O参与该反应,且作氧化剂 | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
分析 反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,从化合价变化的角度分析氧化还原反应.
解答 解:反应的离子方程式为S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,则
A.反应中S元素的化合价升高,被氧化,则S2O32-为还原剂,故A正确;
B.反应中H2O为产物,不是氧化剂,氧化剂为反应物,故B错误;
C.由反应的方程式可知,每生成lmolSO42-,可脱去2molCl2,故C正确;
D.氧化剂氧化性大于氧化产物的氧化性,反应中氧化性:Cl2>SO42-,故D正确.
故选B.
点评 本题考查氧化还原反应,题目难度中等,解答该题的关键是能够写出反应的离子方程式,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 | |
| B. | 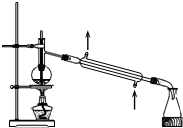 可分离石油,得到汽油、煤油和柴油等各种馏分 可分离石油,得到汽油、煤油和柴油等各种馏分 | |
| C. | 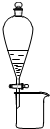 利用此图分离CH3CH2OH和CH3COOC2H5混合液 利用此图分离CH3CH2OH和CH3COOC2H5混合液 | |
| D. | 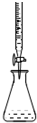 可进行酸碱中和滴定 可进行酸碱中和滴定 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO${\;}_{3}^{-}$=3Fe3++NO↑+4H2O | |
| B. | 向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{加热}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 向NaAlO2溶液中通入过量的CO2:2AlO${\;}_{2}^{-}$+CO2+3H2O=2Al(OH)3↓+CO32- |
1.下列说法正确的是( )
| A. | 用倾析法分离沉淀时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| C. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
15.Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得.己知:
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(3)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01mol、0.01mol、0.01mol、0.01mol.则反应CO2(g)+H2(g)?CO(g)+H2O(g)向逆反应 (填“正反应”或“逆反应”)方向进行,其依据是Qc=$\frac{c(CO)×c(H2O)}{c(CO2)×c(H2)}$=1>0.9=K.
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| T(℃) | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.7 | 2.6 |

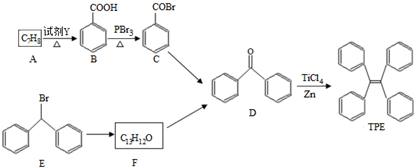
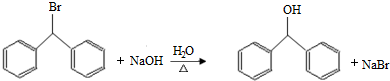 .
.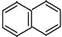 )的一元取代物;
)的一元取代物;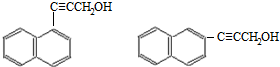 .
.