��Ŀ����
5����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݣ�
���� ��ѧ����CP�� ��500mL��Ʒ�������ữѧʽ��H2SO4��Է���������98�ܶȣ�1.84g/cm3����������98%
��1�����ø�Ũ��������100mL 1mol•L-1��ϡ�ᣮ
�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ��
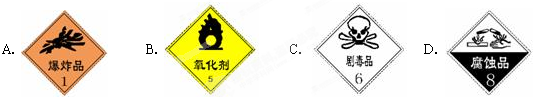
��ش��������⣺��1��ʢ��Ũ������Լ�ƿ��ǩ��Ӧӡ�����о�ʾ����е�D
��2������ϡ����ʱ����ȱ�ٵ������в�������100mL������ƿ��д�������ƣ���
��3�������㣬����100mL1mol•L-1��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ5.4mL����ȡ����ʱӦѡ��AmL������Ͳ��
A��10mL B��50mL C��100mL D��200mL
��4�����ձ���ϡ��Ũ�����ʵ�����Ϊ��Ũ�������ձ��ڻ���ע��װ��ˮ���ձ��У����ò��������Ͻ��裬ʹ��������Ѹ��ɢȥ
��5����������ϡ������вⶨ��������Ũ�ȴ���1mol•L-1�����ƹ��������и�������������������ԭ��ACE��
A������Ͳ��ȡŨ����ʱ�����ӿ̶���ȡŨ����
B������ƿ������ˮϴ�Ӻ�δ���������������ˮ
C����ϡ�ͺ��ϡ��������ת������ƿ�����žͽ����Ժ��ʵ�����
D��ת����Һʱ��������������Һ������ƿ����
E������ʱ����������ƿ�̶��߽��ж���
F�����ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶��ߣ��㲹�伸��ˮ���̶ȴ���
���� ��1��Ũ������ǿ�ᣬ�к�ǿ�ĸ�ʴ�ԣ�
��2���������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ��������
��3���ȼ����Ũ��������ʵ���Ũ��Ϊc=$\frac{1000�Ѧ�}{M}$��Ȼ�������Һϡ�Ͷ���CŨVŨ=CϡVϡ�����㣻���ݡ����������ԭ������Ҫ��ȡ��Ũ����������ѡ����ʵ���Ͳ��
��4������Ũ��������ˮ����������ϡ�Ͳ�����
��5������c=$\frac{n}{V}$��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��� �⣺��1��Ũ������ǿ�ᣬ�к�ǿ�ĸ�ʴ�ԣ���Ӧ����ʴƷ��־����ѡD��
��2���������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪�������������Ͳ���ձ�����������100mL����ƿ�ͽ�ͷ�ιܣ��ʻ�ȱ�ٵ�����Ϊ����������100mL������ƿ���ʴ�Ϊ����������100mL������ƿ��
��3��Ũ��������ʵ���Ũ��Ϊc=$\frac{1000�Ѧ�}{M}$=$\frac{1000��1.84��98%}{98}$=18.4mol/L��������Ũ��������ΪVmL��������Һϡ�Ͷ���CŨVŨ=CϡVϡ��֪��18.4mol/L��VmL=1mol/L��100mL
���V=5.4mL�����ݡ����������ԭ������Ҫ��ȡ��Ũ��������Ϊ5.4mL����֪Ӧѡ�����10mL����Ͳ���ʴ�Ϊ��5.4��A��
��4������Ũ��������ˮ���ȣ���ϡ��ʱӦ��Ũ�������ձ��ڻ���ע��װ��ˮ���ձ��У����ò��������Ͻ��裬ʹ��������Ѹ��ɢȥ���ʴ�Ϊ����Ũ�������ձ��ڻ���ע��װ��ˮ���ձ��У����ò��������Ͻ��裬ʹ��������Ѹ��ɢȥ��
��5��A������Ͳ��ȡŨ����ʱ�����ӿ̶���ȡŨ���ᣬ������ȡ����Һ���ƫ��Ũ��ƫ�ߣ���A��ȷ��
B������ƿ������ˮϴ�Ӻ�δ���������������ˮ����������Һ��Ũ����Ӱ�죬��B����
C����ϡ�ͺ��ϡ��������ת������ƿ�����žͽ����Ժ��ʵ�����������ȴ����Һ���ƫС����Ũ��ƫ�ߣ���C��ȷ��
D��ת����Һʱ��������������Һ��������ƿ���棬����������ʧ����Ũ��ƫ�ͣ���D����
E������ʱ����������ƿ�̶��߽��ж��ݣ�����Һ���ƫС��Ũ��ƫ�ߣ���E��ȷ��
F�����ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶����������ģ��㲹�伸��ˮ���̶ȴ�����Ũ��ƫС����F����
��ѡACE��
���� ���⿼���Ϊ�ۺϣ��漰Ũ����������Լ���Һ�����ƣ�������ѧ���ķ���������ʵ�������Ŀ��飬�ѶȲ���ע����ػ���֪ʶ�Ļ��ۣ�

 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�| A�� | �Ȼ�李��������ơ�����李����ᱵ����ǿ����� | |
| B�� | ��⡢��Ӿ�����롢�绯ѧ��ʴ������ͨ�������²��ܽ��� | |
| C�� | �챦ʯ��ˮ������ʯ����Ҫ�ɷֶ��Ƕ������� | |
| D�� | �������֡�ˮ��������ˮ��������Ϊ����� |
| A�� | SO2��ʹ���������Һ��ɫ | |
| B�� | S��O2��ȼ������SO3 | |
| C�� | ���������Ư��ԭ�����������ͬ | |
| D�� | SO2ͨ��BaC12��Һ���ܲ�����ɫ���� |
| A�� |  �ɴ��Ȼ�����Һ��ֱ�������ᾧ����Ȼ������� �ɴ��Ȼ�����Һ��ֱ�������ᾧ����Ȼ������� | |
| B�� | 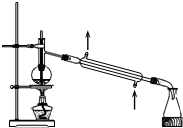 �ɷ���ʯ�ͣ��õ����͡�ú�ͺͲ��͵ȸ������ �ɷ���ʯ�ͣ��õ����͡�ú�ͺͲ��͵ȸ������ | |
| C�� |  ���ô�ͼ����CH3CH2OH��CH3COOC2H5���Һ ���ô�ͼ����CH3CH2OH��CH3COOC2H5���Һ | |
| D�� |  �ɽ�������к͵ζ� �ɽ�������к͵ζ� |
| A�� | ������������ϡ���3FeO+8H++NO${\;}_{3}^{-}$=3Fe3++NO��+4H2O | |
| B�� | ��NaHSO4��Һ�м������Ba��OH��2��Һ��Ba2++2OH-+2H++SO42-=BaSO4��+2H2O | |
| C�� | ������Cu��OH��2����Һ�м�����ȩ��Һ�����ȣ�CH3CHO+2Cu��OH��2+OH-$\stackrel{����}{��}$ CH3COO-+Cu2O��+3H2O | |
| D�� | ��NaAlO2��Һ��ͨ�������CO2��2AlO${\;}_{2}^{-}$+CO2+3H2O=2Al��OH��3��+CO32- |
C ��s��+H2O��g��?CO ��g��+H2 ��g������H=+131.3kJ•mol-1
C ��s��+$\frac{1}{2}$O2��g��=CO ��g������H=-110.5kJ•mo1-1
CO��g��+$\frac{1}{2}$O2��g��=CO2 ��g������H=-283.0kJ•mo1-1
H2 ��g��+$\frac{1}{2}$O2 ��g��=H2O ��g������H=-241.8kJ•mo1-1
H2 ��g��+$\frac{1}{2}$O2 ��g��=H2O ��l������H=-285.8kJ•mo1-1
��1����2.4g ̿ת��Ϊˮú��������ȫȼ������Һ̬ˮ���������̵ġ�H=-78.7kJ•mo1-1��
��2����CO��H2��һ�������¿ɻ�����͵����Ʒ--�״����״���ȼ����Ϊ-726.5kJ/mol����д����CO��H2���ɼ״����Ȼ�ѧ����ʽCO��g��+2H2��g���TCH3OH��l����H=-128.1 kJ/mol��
����1L���ܱ������У����з�Ӧ����CO2��g��+H2��g��?CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| T���棩 | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.7 | 2.6 |
