题目内容
(1)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为 ;该金属元素的相对原子质量为 。
(2) 已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比 .
(2) 已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比 .
(每空2分,共6分)(1)95g/mol,24 (2)2:1
试题分析:二价金属的氯化物中含0.2mol Cl—,则此氯化物的物质的量是0.2mol÷2=0.1mol,所以摩尔质量是9.5g÷0.1mol/L=95g/mol;氯元素的相对原子质量是35.5,所以金属元素的相对原子质量是95-35.5×2=24。
(2)设原混合气体中N2、CO2的分别是x和y。标准状况下,6.72L气体的物质的量是6.72L÷22.4L/mol=0.3mol,则x+y=0.3mol、28x+44y=10.0g,即得解得x=0.2mol、y=0.1mol,所以原混合气体中N2、CO2的体积之比是2:1。
点评:该题是基础性试题的考查,难度不大。试题基础性强,主要是考查学生对以物质的量为核心的有关计算的熟悉掌握程度。该类试题需要注意的是在进行物质的量的有关计算时,关键是熟练应用几个关系式
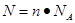 、n=m/M、
、n=m/M、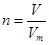 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目