题目内容
NA代表阿伏加德罗常数,下列说法正确的是
- A.1 L pH为3的FeCl3溶液中,由水电离产生的H+离子数目为0.3NA
- B.标准状况下,2.24 L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA
- C.NA个CO2分子和NA个O2分子的体积相同
- D.1 mol C4H10含有非极性键数为4NA个
B
分析:A、FeCl3溶液中H+是水电离产生的,pH为3的FeCl3溶液中c(H+)=10-3mol/L,根据n=cV计算n(H+),再根据N=nNA计算;
B、根据n=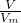 计算氯气的物质的量,反应中氯元素的化合价由0价降低为-1价,据此计算转移电子的物质的量,再根据N=nNA计算;
计算氯气的物质的量,反应中氯元素的化合价由0价降低为-1价,据此计算转移电子的物质的量,再根据N=nNA计算;
C、分子数目相同,影响气体体积的因素有温度、压强;
D、分子中C-C键是非极性键,1mol C4H10含有3molC-C键.
解答:A、pH为3的FeCl3溶液中c(H+)=10-3mol/L,n(H+)=1L×10-3mol/L=0.001mol,由水电离产生的H+离子数目为0.001NA,故A错误;
B、标准状况下,2.24 L Cl2的物质的量为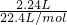 =0.1mol,反应中氯元素的化合价由0价降低为-1价,故转移电子的物质的量为0.2mol,转移电子数目为0.2NA,故B正确;
=0.1mol,反应中氯元素的化合价由0价降低为-1价,故转移电子的物质的量为0.2mol,转移电子数目为0.2NA,故B正确;
C、二氧化碳与氧气所处的温度、压强不一定相同,NA个CO2分子和NA个O2分子的体积不一定相同,故C错误;
D、1mol C4H10含有3molC-C键,故含有的非极性键数为3NA个,故D错误;
故选B.
点评:考查常用化学计量的有关计算,难度不大,注意C选项为易错点,注意气体摩尔体积的使用条件.
分析:A、FeCl3溶液中H+是水电离产生的,pH为3的FeCl3溶液中c(H+)=10-3mol/L,根据n=cV计算n(H+),再根据N=nNA计算;
B、根据n=
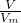 计算氯气的物质的量,反应中氯元素的化合价由0价降低为-1价,据此计算转移电子的物质的量,再根据N=nNA计算;
计算氯气的物质的量,反应中氯元素的化合价由0价降低为-1价,据此计算转移电子的物质的量,再根据N=nNA计算;C、分子数目相同,影响气体体积的因素有温度、压强;
D、分子中C-C键是非极性键,1mol C4H10含有3molC-C键.
解答:A、pH为3的FeCl3溶液中c(H+)=10-3mol/L,n(H+)=1L×10-3mol/L=0.001mol,由水电离产生的H+离子数目为0.001NA,故A错误;
B、标准状况下,2.24 L Cl2的物质的量为
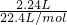 =0.1mol,反应中氯元素的化合价由0价降低为-1价,故转移电子的物质的量为0.2mol,转移电子数目为0.2NA,故B正确;
=0.1mol,反应中氯元素的化合价由0价降低为-1价,故转移电子的物质的量为0.2mol,转移电子数目为0.2NA,故B正确;C、二氧化碳与氧气所处的温度、压强不一定相同,NA个CO2分子和NA个O2分子的体积不一定相同,故C错误;
D、1mol C4H10含有3molC-C键,故含有的非极性键数为3NA个,故D错误;
故选B.
点评:考查常用化学计量的有关计算,难度不大,注意C选项为易错点,注意气体摩尔体积的使用条件.

练习册系列答案
相关题目