题目内容
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是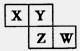
| A.X、Y、Z的原子半径大小:X>Y>Z |
| B.X、W的气态氢化物能相互反应,生成共价化合物 |
| C.Z、W的最高价氧化物对应水化物的酸性,前者更强 |
| D.Y的单质与氢气反应较Z剧烈 |
D
解析

练习册系列答案
相关题目
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | |
| 4 | J | | | | | | k | |
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点:
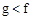
B.最高价氧化物对应水化物的酸性:
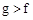
C.最高价氧化物对应水化物的溶解性:
D.f不能与氢气反应,g能与氢气反应
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.气态氢化物的热稳定性:HnY>HnW |
| B.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.原子半径:丙>乙>甲>丁 |
| B.气态氢化物的稳定性:甲>丙 |
| C.最高价氧化物对应的水化物的酸性:丁>甲 |
| D.乙和甲或乙和丁所能形成的化合物都是剧毒物质 |
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。下列判断不正确的是
| | | A | |
| B | C | | D |
A.最简单气态氢化物的热稳定性:A>C
B.最高价氧化物对应水化物的酸性:C<D
C.原子半径:B>C>A
D.含B元素的盐溶液一定显酸性
已知W、X、Y、Z是短周期元素,aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列说法正确的是
| A.离子的还原性:Y2-> Z- |
| B.原子半径:r(W) > r(X) |
| C.质子数:c>a |
| D.W和X两者最高价氧化物对应的水化物能相互反应 |
X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
| A.X最高价氧化物对应的水化物不一定是强酸 |
| B.X元素的氢化物化学式一定为H2X |
| C.X的单质—定是良好的半导体材料 |
| D.X元素的氧化物—定能与烧碱反应 |
利用中学所学相关规律,下列推断正确的一项是
| A.碳酸钡的溶解度略大于硫酸钡,向硫酸钡的饱和溶液中加入较多的碳酸钠固体,会有碳酸钡生成 |
B.某温度T时,水的离子积常数为KW,该温度下将V1mLa mol?L-1的一元酸HA与V2mLb mol?L-1的一元碱BOH充分混合,若混合溶液中c(OH-)= mol?L-1,则此溶液不一定呈中性 mol?L-1,则此溶液不一定呈中性 |
| C.ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 |
D.依据反应2C+SiO2 2CO↑+Si ,还原性:Si <C 2CO↑+Si ,还原性:Si <C |