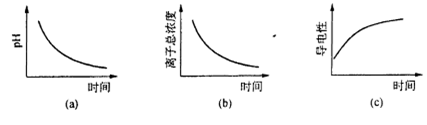
题目内容
工业上常利用反应 3Cl2+8NH3 =6NH4Cl+N2 检查氯气管道是否漏气。回答下列问题:
(1)该反应中,氧化剂是 ,发生氧化反应的物质是 。
(2)该反应中氧化剂与还原剂的物质的量之比为 。
(3)若标准状况下有6.72L N2生成,则转移电子的物质的量为 mol。
(1)该反应中,氧化剂是 ,发生氧化反应的物质是 。
(2)该反应中氧化剂与还原剂的物质的量之比为 。
(3)若标准状况下有6.72L N2生成,则转移电子的物质的量为 mol。
(1)Cl2 NH3 (写物质名称也可) (2)3:2 (3)1.8
试题分析:(1)根据反应的方程式可知,氯元素的化合价从0价降低到-1价,得到1个电子,氯气是氧化剂;氨气中氮元素的化合价从-3价升高到0价,失去3个电子,氨气是还原剂,发生氧化反应。
(2)根据电子的得失守恒可知,该反应中氧化剂与还原剂的物质的量之比为3:2。
(3)标准状况下6.72L N2的物质的量是6.72L÷22.4L/mol=0.3mol,所以转移电子的物质的量为0.3mol×6=1.8mol。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点之一,侧重对基础知识的巩固与训练的,难度不大。该题的关键是准确判断出有关元素的化合价变化情况,然后根据有关概念灵活运用、分析、判断即可。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
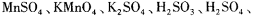
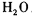 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系: