题目内容
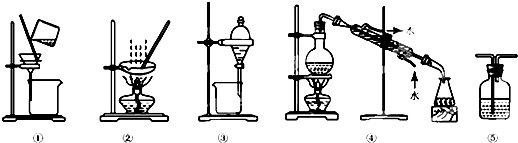
下列实验中,实验设计及所选装置合理的是
- A.回收碘的四氯化碳溶液中的四氯化碳,选④
- B.用酒精提取碘水中的碘,选③
- C.将HCl气体从长导管通入并用水吸收,选⑤
- D.粗盐提纯,选①和②
AD
分析:A.分离碘和四氯化碳,应用蒸馏的方法;
B.酒精和水混溶;
C.HCl易溶于水,易产生倒吸;
D.粗盐提纯可用到过滤和蒸发操作.
解答:A.碘和四氯化碳沸点不同,可用蒸馏的方法分离,故A正确;
B.酒精和水混溶,不能用分液的方法分离,应用蒸馏的方法,故B错误;
C.HCl易溶于水,易产生倒吸,不能插入到液面以下,故C错误;
D.粗盐提纯可用到过滤和蒸发操作,故D正确.
故选AD.
点评:本题综合考查物质的分离,题目难度不大,注意把握物质的性质的异同,为解答该题的关键,易错点为D,注意把握粗盐提纯的原理和操作方法.
分析:A.分离碘和四氯化碳,应用蒸馏的方法;
B.酒精和水混溶;
C.HCl易溶于水,易产生倒吸;
D.粗盐提纯可用到过滤和蒸发操作.
解答:A.碘和四氯化碳沸点不同,可用蒸馏的方法分离,故A正确;
B.酒精和水混溶,不能用分液的方法分离,应用蒸馏的方法,故B错误;
C.HCl易溶于水,易产生倒吸,不能插入到液面以下,故C错误;
D.粗盐提纯可用到过滤和蒸发操作,故D正确.
故选AD.
点评:本题综合考查物质的分离,题目难度不大,注意把握物质的性质的异同,为解答该题的关键,易错点为D,注意把握粗盐提纯的原理和操作方法.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目