题目内容
【题目】某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:

(1)试管乙中发生的现象是 ,该现象能说明产生的气体具有 性。
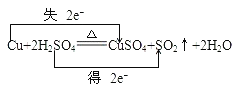
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
(3)试管乙口部浸有碱液的棉花的作用是 。
(4)SO 2 的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH) 2 溶液至不再产生沉淀时,恰好消耗20.00 mL Ba(OH) 2 溶液。请计算:
①该雨水中共溶解标准状况下SO 2 的体积多少mL?
②若生成沉淀物的质量为2.25 g,求出沉淀物的组成。(请写出计算过程)
【答案】(1)品红溶液褪色; 漂白
(2)
(3)吸收SO2 ;
(4)224; BaSO3 和BaSO4
【解析】
试题分析:(1)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫,生成的二氧化硫能使品红褪色,说明二氧化硫具有漂白性;
(2)金属铜和浓硫酸发生反应生成硫酸铜、水和二氧化硫Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下:
CuSO4+SO2↑+2H2O,化合价的升高值=化合价的降低值=转移电子数=2,电子转移情况如下: ,;
,;
(3)二氧化硫有毒,属于酸性氧化物,能和碱反应生成盐和水,在装置口处浸有碱液的棉花可以和二氧化硫反应吸收二氧化硫;
(4)①二氧化硫和氢氧化钡的反应方程式为:SO2+Ba(OH)2=BaSO3↓+H2O,设该雨水中共溶解SO2的体积是x,则

则![]() =0.02,解得x=0.448L=448mL;
=0.02,解得x=0.448L=448mL;
②0.5mol/L、40.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.02mol×217g/mol=4.34g,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.02mol×233g/mol=4.66g,4.34g<4.50g<4.66g,所以沉淀物的组成为BaSO3和BaSO4。

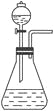
【题目】如右图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2 、HCl和O2 。供选用的试剂有:
A.浓H2SO4 |
B.浓盐酸 |
C.食盐 |
D.二氧化锰 |
E.KMnO4
F.H2O2
(1)若要快速制备Cl2 应选择_____________________________;
(2)若要快速制备少量HCl,应选择_________________________;
(3)若要快速制备少量O2 ,应选择_________________________。