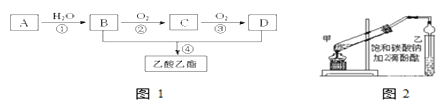
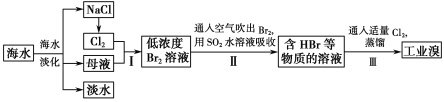
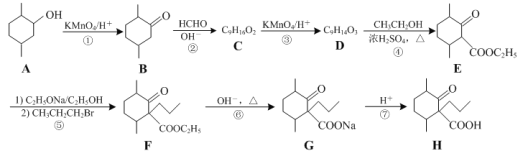
题目内容
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+→Cu2++2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2+H2O→2Na++2OH-+O2↑
C.将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO-
D.铁与盐酸反应:2Fe + 6H+→2Fe3++3H2↑
【答案】A
【解析】
A.用FeCl3溶液腐蚀铜线路板,反应生成氯化铁、氯化铜。
B.原子个数不守恒。
C.次氯酸为弱电解质,应保留化学式。
D.铁与盐酸反应生成二价铁。
A.用FeCl3溶液腐蚀铜线路板,离子方程式:![]() ,故A正确。
,故A正确。
B.Na2O2与H2O反应制备O2,离子方程式:![]() ,故B错误。
,故B错误。
C.将氯气溶于水制备次氯酸,离子方程式:![]() ,故C错误。
,故C错误。
D.铁与盐酸反应生成二价铁:![]() ,故D错误。
,故D错误。
答案选A。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目