题目内容
下列化学实验事实及解释都正确的是
| A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力 |
B.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
| C.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数 |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 |
C
选项A中锌把铜置换出来,构成铜锌原电池加快反应速率,而不是催化剂。等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。
 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。
练习册系列答案
相关题目
 Ca2+(aq)+2OH-(aq),下列叙述正确的是
Ca2+(aq)+2OH-(aq),下列叙述正确的是
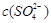 的增大而减小
的增大而减小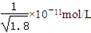
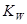 ,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是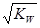
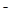 )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl