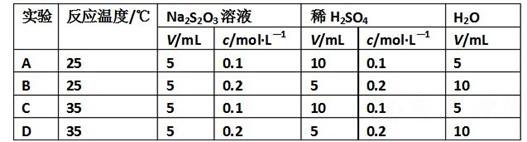
题目内容
一定温度下在体积为5 L的密闭容器中发生可逆反应。(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=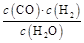
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。
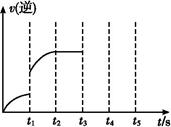
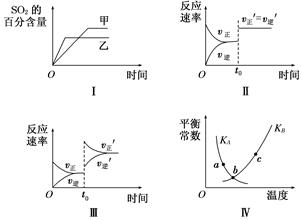
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。
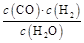
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v正(H2O)=v逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总质量不随时间而变化 |
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。

(Ⅰ)(1)C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(2)A、B、C (Ⅱ)(1)0.03/(t2-t1)mol·L-1·s-1
(2)不 0.7
(3)使用了催化剂 增大了H2的浓度
综合演练
 CO(g)+H2 (g)
CO(g)+H2 (g)(2)A、B、C (Ⅱ)(1)0.03/(t2-t1)mol·L-1·s-1
(2)不 0.7
(3)使用了催化剂 增大了H2的浓度
综合演练
(Ⅰ)(1)根据化学平衡常数的定义,找出反应物、生成物以及系数,写出方程式C(s)+H2O(g) CO(g)+H2 (g)。
CO(g)+H2 (g)。
(2)由于C是固体,因此随着反应的进行,容器中气体的平均相对分子质量随着时间而变化,A正确; v正(H2O)=v逆(H2),说明正、逆反应速率相等,B对;由于C是固体,因此随着反应的进行,容器中气体的质量随着时间而变化,而体积不变,因此密度随时间而变化,而总质量一直不发生变化,所以C可作为判断平衡的标志,而D不能。消耗n mol H2的同时消耗n mol CO均为逆反应速率,不能判断该反应一定达到化学平衡状态。
(Ⅱ)(1)v(H2)="(0.35-0.20)" mol/5 L·(t2-t1)=0.03/(t2-t1) mol·L-1·s-1。
(2)Fe为固体,加入2 mol Fe,则平衡不移动。再通入1 mol H2O(g),相当于在原来通入1 mol H2O(g)的基础上浓度加倍,相当于加压,但由于该反应前后气体体积不变,所以相对于通入1 mol H2O(g)时处于相同的平衡状态,但各物质的浓度是原来的2倍,所以n(H2)="0.7" mol。
(3)使用催化剂、增大H2的浓度均可提高逆反应速率。
 CO(g)+H2 (g)。
CO(g)+H2 (g)。(2)由于C是固体,因此随着反应的进行,容器中气体的平均相对分子质量随着时间而变化,A正确; v正(H2O)=v逆(H2),说明正、逆反应速率相等,B对;由于C是固体,因此随着反应的进行,容器中气体的质量随着时间而变化,而体积不变,因此密度随时间而变化,而总质量一直不发生变化,所以C可作为判断平衡的标志,而D不能。消耗n mol H2的同时消耗n mol CO均为逆反应速率,不能判断该反应一定达到化学平衡状态。
(Ⅱ)(1)v(H2)="(0.35-0.20)" mol/5 L·(t2-t1)=0.03/(t2-t1) mol·L-1·s-1。
(2)Fe为固体,加入2 mol Fe,则平衡不移动。再通入1 mol H2O(g),相当于在原来通入1 mol H2O(g)的基础上浓度加倍,相当于加压,但由于该反应前后气体体积不变,所以相对于通入1 mol H2O(g)时处于相同的平衡状态,但各物质的浓度是原来的2倍,所以n(H2)="0.7" mol。
(3)使用催化剂、增大H2的浓度均可提高逆反应速率。

练习册系列答案
相关题目
 B(g)+C(g),增大压强正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强正反应速率减小,逆反应速率增大
 CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
 C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下: