题目内容
20.按要求回答下列问题:(1)已知100℃时,Kw=1.0×10-12.将一定体积pH=10的NaOH溶液和一定体积的pH=3的H2SO4溶液混合,所得混合溶液pH=7.则NaOH溶液和H2SO4溶液的体积比为3:2(忽略混合时溶液体积的变化).
(2)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4.已知25℃时,0.05mol•L-1(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3•H2O)=1.7×1011-a(用含a的代数式表示,已知NH3•H2O的电离常数Kb=1.7×10-3)
(3)常温下,向V L 0.1mol•L-1的醋酸溶液中加水稀释,下列说法正确的是B(填字母).
A、溶液中导电粒子的数目将减少 B、由水电离的c(H+)浓度将增大
C、溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 D、溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$将增大
E、醋酸的电离程度将增大,c(H+)也增大
(4)已知反应:4NH3+3O2═2N2+6H2O,现将该反应设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 (1)pH=3的H2SO4溶液,c(H+)=1×10-3mol/L,pH=10的NaOH溶液,c(OH-)=1×10-2mol/L,要使混合液的pH=7,则碱剩余,据此计算;
(2)根据氨水的电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$代入数据进行计算即可;
(3)醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,根据醋酸的电离程度确定溶液中微粒个数变化;
(4)燃料电池中,负极是燃料发生失电子的氧化反应.
解答 解:(1)pH=3的H2SO4溶液,c(H+)=1×10-3mol/L,pH=10的NaOH溶液,c(OH-)=1×10-2mol/L,pH=3的H2SO4溶液和pH=10的NaOH溶液混合,要使混合液的pH=7,则碱剩余,则有$\frac{1{0}^{-2}{V}_{1}-1{0}^{-3}{V}_{2}}{{V}_{1}+{V}_{2}}$=10-5,V1:V2=3:2,故答案为:3:2;
(2)0.05mol•L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10-3mol.L-1,所以$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1.7×1{0}^{-3}}{1×1{0}^{a-14}}$=1.7×1011-a,故答案为:1.7×1011-a;
(3)A、醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,即溶液中导电粒子的数目将增多,故A错误;
B、加水稀释,促进电离,但离子浓度降低,酸性减弱,对水的电离的抑制程度减弱,即由水电离的c(H+)浓度将增大,故B正确;
C、溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{Ka}{Kw}$=常数,只受温度的影响,所以加水后数值不变,故C错误;
D、醋酸电离产生的醋酸根离子和氢离子数目增多,浓度同等程度的减小,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$将不变,故D错误;
E、加水稀释,醋酸的电离程度将增大,c(H+)减小,故E错误.
故选B;
(4)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了弱电解质的电离、酸碱混合后溶液pH的计算等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法是关键,试题培养了学生的分析、理解能力及化学计算能力.

| A. | Na+ | B. | NH4+ | C. | CH4 | D. | F- |
| A. | 11.2g | B. | 16.8g | C. | 33.6g | D. | 5.6g |
| A. | CH4 | B. | C2H4 | C. | C6H6 | D. | C3H6 |
①NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④浓的氢氟酸溶液中存在HF2-和H2F3-
⑤水和乙醇分别与金属钠反应,前者比后者剧烈
⑥水分子在较高温度下也很稳定.
| A. | ①④⑤⑥ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③⑥ |
| A. | 石油分馏和煤的液化均为物理变化 | |
| B. | 石油裂解的目的是为了提高汽油等轻质油的产量和质量 | |
| C. | 石油分馏实验中,温度计水银球插入石油中但不能碰到瓶壁 | |
| D. | 煤干馏得到的煤焦油中可以分离出苯、甲苯等有机物 |
| A. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| B. | 只有在标准状况下,气体的摩尔体积才能约是22.4L•mol-1 | |
| C. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定 | |
| D. | 一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定 |
| A. | 裂解和裂化均为化学变化 | |
| B. | 乙烯、苯分子中的所有原子都在同一平面上 | |
| C. | 裂化和裂解均是将相对分子质量大的烃断裂成相对分子质量小的烃的过程 | |
| D. | 实验室蒸馏石油的实验中,冷凝管的水流方向是上方进水下方出水 |
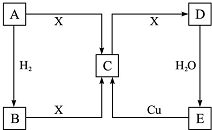 已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.
已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.