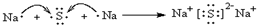题目内容
13.下列溶液中,一定呈中性的是( )| A. | 由非电解质溶于水得到的溶液 | |
| B. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
分析 A.由非电解质溶于水得到的溶液可能呈酸性、碱性或中性;
B.任何水溶液中只要c(H+)=c(OH-),则该溶液就一定呈中性;
C.等物质的量的强酸与强碱反应得到的溶液可能呈酸性、碱性或中性;
D.碱无论如何稀释都不能得到酸性或中性溶液.
解答 解:A.由非电解质溶于水得到的溶液可能呈酸性、碱性或中性,如二氧化硫、三氧化硫溶液呈酸性,氨气水溶液呈碱性,乙醇溶液呈中性,故A错误;
B.该溶液中存在c(H+)=c(OH-),则该溶液就一定呈中性,故B正确;
C.等物质的量的强酸与强碱反应得到的溶液可能呈酸性、碱性或中性,如硫酸和NaOH的混合溶液呈酸性、稀盐酸和氢氧化钠溶液呈中性、盐酸和氢氧化钡溶液呈碱性,故C错误;
D.碱无论如何稀释都不能得到酸性或中性溶液,所以将pH=9的烧碱溶液稀释100倍所得到的溶液呈碱性,接近中性,故D错误;
故选B.
点评 本题考查溶液酸碱性判断,注意不能关键溶液pH判断溶液酸碱性,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,易错选项是D.

练习册系列答案
相关题目
3.将甲、乙两种金属的性质相比较,能说明甲的金属性比乙强的是( )
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某非金属反应时甲原子失电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,甲作负极.
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某非金属反应时甲原子失电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,甲作负极.
| A. | ①④ | B. | ③⑤ | C. | ①②③④⑤ | D. | ①②③⑤ |
4.下列粒子结构示意图中,属于阴离子的是( )
| A. |  | B. | 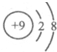 | C. | 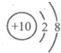 | D. | 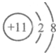 |
1.25℃时,下列说法正确的是( )
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)=c(H+) | |
| B. | 水离出来的c(H+)=l.0×10-13 mol/L的溶液中,Al3+可能大量存在 | |
| C. | 0.1 mol/LNaHCO3溶液中:c(Na+)=c(HCO3- )+2c(CO3 2-)+c(H2CO3) | |
| D. | O.lmol/L的氨水中滴加稀盐酸至过量,不可能有:c(Cl-)>c(NH4 +)>c(H+)>c(OH-) |
8.不同元素的原子(包括离子)( )
| A. | 质子数一定不等 | B. | 中子数一定不等 | ||
| C. | 质量数一定不等 | D. | 核外电子数一定不等 |
3.下列说法正确的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 同种非金属元素间不可能形成离子键 | |
| C. | 非金属元素间不可能形成离子化合物 | |
| D. | 分子中一定存在共价键 |

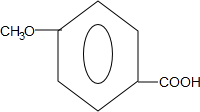 .
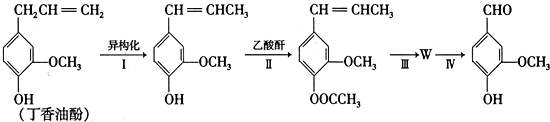
.
 )
) 合成丁香油酚的反应类型为取代反应.
合成丁香油酚的反应类型为取代反应.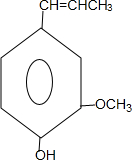 +CH3OCOCOCH3→
+CH3OCOCOCH3→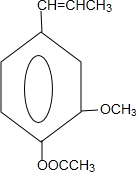 +CH3COOH
+CH3COOH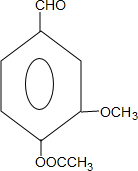 .
. .
. .
. .元素D在元素周期表中的位置是第三周期第VIIA族.
.元素D在元素周期表中的位置是第三周期第VIIA族. 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程