��Ŀ����
����Ŀ��ij�о�С��ͬѧͨ������������ȡ������ˮ��ϡ����ĻƼ������[KNH4Fex��SO4��y��OH��z]����ͨ��ʵ��ⶨ��Ʒ�лƼ���������й���ɣ� 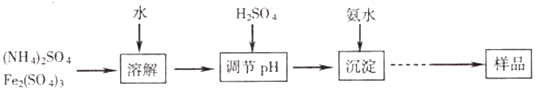
ʵ��ⶨ��
�ٳ�ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00.00mL ��ҺA��
����ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32g��
����ȡ25.00mL��ҺA����������KI����2.000molL��1Na2S2O3��Һ���еζ�����֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6 �� ����30.00mL Na2S2O3��Һ���յ㣮
��1����[KNH4Fex��SO4��y��OH��z]��x��y��z�Ĵ�����ϵʽΪ ��
��2��������H2SO4��pH����Ϊ2������Һc��Fe3+ ��ӦΪmolL��1����֪Ksp[Fe��OH��3]��=4.0x10��38��
��3��ʵ��ⶨ�ڣ���������Ƿ���ȫ�ķ����� ��
��4����������ʵ�����ݼ�����Ʒ�е�n��Fe3+����n��SO42������д��������̣�
���𰸡�
��1��3x+2=2y+z
��2��0.04
��3�����ã�ȡ���ɳ�������ϲ���Һ1��2ml���μ��������ữ���Ȼ�����Һ�����ް�ɫ�������ɣ��������������ȫ
��4��n��SO42����=n��BaSO4��= ![]() =0.04mol��
=0.04mol��
2Fe3+ | �� | I2 | �� | 2Na2S2O3 |
2 | 1 | 2 |
n��Fe3+��=2n��I2��=n��Na2S2O3��=2.000mol/L��0.03L=0.06mol��
��Ʒ�е�n��Fe3+����n��SO42����=0.06mol��0.04mol=3��2
���������⣺��1����[KNH4Fex��SO4��y��OH��z]�У�KԪ�ػ��ϼ�+1�ۣ�NԪ�ػ��ϼ۩�3�ۣ�HԪ�ػ��ϼ�+1�ۣ�SO42�����ϼ۴�����Ϊ��2�ۣ�OH�����ϼ۴�����Ϊ��1�ۣ�+1+����3��+��+1����4++3x+����2y��+����1��z��=0��x��y��z�Ĵ�����ϵʽΪ��3x+2=2y+z��
���Դ��ǣ�3x+2=2y+z����2��������H2SO4��pH����Ϊ2��c��OH����= ![]() =10��12mol/L��Ksp[Fe��OH��3]��=4.0x10��38=c��Fe3+��c3��OH������c��Fe3+��=
=10��12mol/L��Ksp[Fe��OH��3]��=4.0x10��38=c��Fe3+��c3��OH������c��Fe3+��= ![]() =0.04mol/L��
=0.04mol/L��
���Դ��ǣ�0.04����3��ʵ��ⶨ�ڣ���������Ƿ���ȫ�ķ����ǣ����ã�ȡ���ɳ�������ϲ���Һ1��2ml���μ��������ữ���Ȼ�����Һ�����ް�ɫ�������ɣ��������������ȫ��
���Դ��ǣ����ã�ȡ���ɳ�������ϲ���Һ1��2ml���μ��������ữ���Ȼ�����Һ�����ް�ɫ�������ɣ��������������ȫ����4���ٳ�ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00.00mL ��ҺA��
����ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32g��
����ȡ25.00mL��ҺA����������KI����2.000molL��1Na2S2O3��Һ���еζ�����֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6 �� ����30.00mL Na2S2O3��Һ���յ㣮
25ml��Һ��������������ʵ��������ᱵ���ʵ�����ͬ��n��SO42����=n��BaSO4��= ![]() =0.04mol��
=0.04mol��
2Fe3+ | �� | I2 | �� | 2Na2S2O3 |
2 | 1 | 2 |
n��Fe3+��=2n��I2��=n��Na2S2O3��=2.000mol/L��0.03L=0.06mol��
��Ʒ�е�n��Fe3+����n��SO42����=0.06mol��0.04mol=3��2��
���Դ��ǣ�n��SO42����=n��BaSO4��= ![]() =0.04mol��
=0.04mol��
2Fe3+��I2��2Na2S2O3
2 1 2
n��Fe3+��=2n��I2��=n��Na2S2O3��=2.000mol/L��0.03L=0.06mol��
��Ʒ�е�n��Fe3+����n��SO42����=0.06mol��0.04mol=3��2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����������һ�ֳ��õ�����������ͼ���������̿���Ҫ�ɷ�ΪMnO2���Ʊ�������ص�һ�ֹ��գ������в��ֲ�������ȥ���� 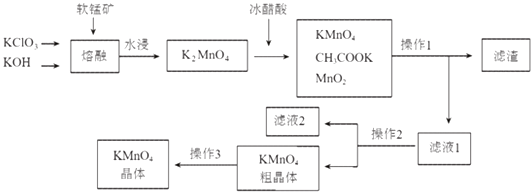
������ʲ�ͬ�¶��µ��ܽ�ȣ���λ��g�����������
���� | KMnO4 | CH3COOK | K2SO4 | KCl |
20�� | 6.34 | 217 | 11.1 | 34.2 |
90�� | 45.2 | 398 | 22.9 | 53.9 |
��1�������ڡ����跴Ӧ�Ļ�ѧ����ʽΪ ��
��2��K2MnO4��Һ�м�������ᷢ����Ӧ�����ӷ���ʽΪ�� ��
��3������2������ ��
��4��ͼ�п���ֱ�ӽ���ѭ�����õ������ǣ��ѧʽ�� ��
��5��KMnO4�־����е���Ҫ���ʣ��ѧʽ������ �� �����������ͼ�еı����ᣬ���µ����⼰ԭ���� ��