题目内容
9.(1)N2(g)与H2(g)反应生成17g NH3(g),放出46.1KJ 热量,写出热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol(2)已知H-H键能为a KJ/mol,H-N键能为b KJ/mol,N≡N键的键能是c KJ/mol根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=(c+3a-6b)kJ/mol
(3)写出在碱性条件下氢氧燃料电池的电极反应:负极:2H2-4e-+4OH-=2H2O.
分析 (1)N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2KJ,依据热化学方程式书写得到;
(2)反应热=反应物的总键能-生成物的总键能,据此计算;
(3)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应.
解答 解:(1)N2(g)与H2(g)反应生成1mol NH3(g),放出46.1KJ热量,生成2mol NH3(g),放热92.2KJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol;
(2)已知H-H键能为a KJ/mol,H-N键能为b KJ/mol,N≡N键的键能是c KJ/mol,反应热=反应物的总键能-生成物的总键能=c kJ•mol-1+3×a kJ•mol-1-2×3×b kJ•mol-1=(c+3a-6b)kJ/mol,故答案为:(c+3a-6b)kJ/mol;
(3)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,碱性溶液中负极反应为2H2-4e-+4OH-=2H2O,故答案为:2H2-4e-+4OH-=2H2O.
点评 本题考查反应热的有关计算和电极反式的书写,题目难度不大,掌握反应热与键能的关系是关键.

练习册系列答案
相关题目
19.下列有关氯气的叙述中,不正确的是( )
| A. | 氯气是一种黄绿色、有刺激性气味的气体 | |
| B. | 氯气、液氯和氯水是同一种物质 | |
| C. | 氯气能溶于水 | |
| D. | 氯气是一种用于给自来水消毒的有毒气体 |
20.下列说法正确的是( )
| A. | 凡是能导电的物质都是电解质 | |
| B. | 凡是不能导电的物质一定是非电解质 | |
| C. | 电解质溶液能导电的原因是溶液中存在自由移动的离子 | |
| D. | 盐酸能导电的原因是溶液在电流作用下电离成了自由移动的离子的缘故 |
17.除去溴苯中少量溴的方法是( )
| A. | 加入苯使之反应 | B. | 加入较大量的CCl4萃取静置后分液 | ||
| C. | 加入KI溶液 | D. | 加入较大量NaOH溶液后静置分液 |
4.以下说法正确的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 自发反应在任何条件下都能进行,不自发的反应在任何条件下都不能进行 | |
| C. | 放热反应速率总是大于吸热反应速率 | |
| D. | 1gH2完全燃烧生成水蒸气时放出热量为121kJ,完全断裂1mol O=O键、H-O键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ |
14.下列有关氯水的叙述中正确的是( )
| A. | 新制氯水只含有氯分子和次氯酸分子 | |
| B. | 氯水光照时有气泡逸出,该气体的主要成分是氯气 | |
| C. | 氯水放置数天后,其酸性逐渐减弱 | |
| D. | 新制氯水可使紫色石蕊试液先变红后褪色 |
19.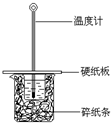 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )| A. | 实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若将盐酸体积改为60 mL,理论上所求中和热不相等 |