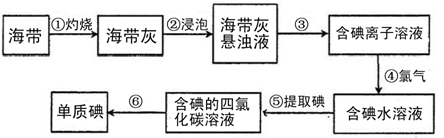
题目内容
海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

已知:四氯化碳沸点是76.8℃,碘单质的沸点是184.35℃.
请填写下列空白:
(1)填下列实验操作的名称:步骤③
(2)步骤④:在滤液中加入1~2mL 2mol?L-1H2SO4溶液,再加入
(3)步骤⑤中,某学生选择用四氯化碳来提取碘的理由是
(4)步骤⑤中使用到分液漏斗,使用之前需检验其是否漏液:向分液漏斗中加入少量水,检查
(5)检验提取碘后的水溶液中是否还含有单质碘,可选用的试剂是

已知:四氯化碳沸点是76.8℃,碘单质的沸点是184.35℃.
请填写下列空白:
(1)填下列实验操作的名称:步骤③
过滤
过滤
;步骤⑥蒸馏
蒸馏
;(2)步骤④:在滤液中加入1~2mL 2mol?L-1H2SO4溶液,再加入
H2O2溶液或氯水
H2O2溶液或氯水
溶液,反应的离子方程式是2I-+H2O2+2H+═I2+2H2O或2I-+Cl2═I2+2Cl-
2I-+H2O2+2H+═I2+2H2O或2I-+Cl2═I2+2Cl-
.(3)步骤⑤中,某学生选择用四氯化碳来提取碘的理由是
四氯化碳与水互不相溶;碘在四氯化碳中的溶解度比在水中大
四氯化碳与水互不相溶;碘在四氯化碳中的溶解度比在水中大
.(4)步骤⑤中使用到分液漏斗,使用之前需检验其是否漏液:向分液漏斗中加入少量水,检查
旋塞芯
旋塞芯
处是否漏水;将漏斗倒转过来,检查玻璃塞
玻璃塞
处是否漏水,待确认不漏水后方可使用.(5)检验提取碘后的水溶液中是否还含有单质碘,可选用的试剂是
淀粉溶液
淀粉溶液
.分析:(1)分离固体和液体用过滤,分离互溶的两种液体用蒸馏;
(2)碘离子具有还原性,H2O2具有较强的氧化性,在酸性条件下可氧化碘离子;Cl2可氧化碘离子成碘单质;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(4)分液漏斗能用来盛放液体,且有活塞,使用时必须检查是否漏水,根据检验分液漏斗是否漏水的方法解答;
(5)根据碘单质的特性遇淀粉显蓝色来检验;
(2)碘离子具有还原性,H2O2具有较强的氧化性,在酸性条件下可氧化碘离子;Cl2可氧化碘离子成碘单质;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(4)分液漏斗能用来盛放液体,且有活塞,使用时必须检查是否漏水,根据检验分液漏斗是否漏水的方法解答;
(5)根据碘单质的特性遇淀粉显蓝色来检验;
解答:解:(1)步骤③是分离固体和液体得含碘离子的滤液,则实验操作为过滤,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:过滤;蒸馏;
(2)碘离子具有还原性,H2O2具有较强的氧化性,在酸性条件下可氧化碘离子反应的离子方程式为H2O2+2I-+2H+=I2+2H2O,Cl2具有强氧化性也可氧化碘离子成碘单质,反应的离子方程式为Cl2+2I-=2Cl-+I2,
故答案为:H2O2溶液或氯水,2I-+H2O2+2H+═I2+2H2O或,2I-+Cl2═I2+2Cl-;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,四氯化碳与水互不相溶,碘在四氯化碳中的溶解度比在水中大;
故答案为:四氯化碳与水互不相溶;碘在四氯化碳中的溶解度比在水中大;
(4)分液漏斗是用普通玻璃制成,漏斗颈部有旋塞芯玻璃活塞,使用之前需检验其是否漏液:向分液漏斗中加入少量水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞处是否漏水,不漏水的分液漏斗方可使用,
故答案为:旋塞芯;玻璃塞;
(5)淀粉溶液遇碘变蓝色,可用来检验碘单质,
故答案为:淀粉溶液;
故答案为:过滤;蒸馏;
(2)碘离子具有还原性,H2O2具有较强的氧化性,在酸性条件下可氧化碘离子反应的离子方程式为H2O2+2I-+2H+=I2+2H2O,Cl2具有强氧化性也可氧化碘离子成碘单质,反应的离子方程式为Cl2+2I-=2Cl-+I2,
故答案为:H2O2溶液或氯水,2I-+H2O2+2H+═I2+2H2O或,2I-+Cl2═I2+2Cl-;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,四氯化碳与水互不相溶,碘在四氯化碳中的溶解度比在水中大;
故答案为:四氯化碳与水互不相溶;碘在四氯化碳中的溶解度比在水中大;
(4)分液漏斗是用普通玻璃制成,漏斗颈部有旋塞芯玻璃活塞,使用之前需检验其是否漏液:向分液漏斗中加入少量水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞处是否漏水,不漏水的分液漏斗方可使用,
故答案为:旋塞芯;玻璃塞;
(5)淀粉溶液遇碘变蓝色,可用来检验碘单质,
故答案为:淀粉溶液;
点评:本题主要考查从海带中提取碘的实验,明确物质的分离方法及碘单质的性质是解答的关键,题目难度中等.

练习册系列答案
相关题目