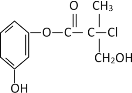
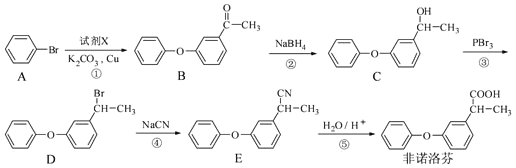
题目内容
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( )

A.A点所得溶液中:Vo等于l0mL
B.B点所得溶液中:c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
C.C点所得溶液中:c(Na+)>3c(HSO3-)
D.D点所得溶液中水解平衡常数:Kh1=10-6.81
【答案】A
【解析】
A.pH=1.85时,溶液中c(H+)=10-1.85,由Ka1=![]() =10-1.85可得c(HSO3-)=c(H2SO3),若Vo等于l0mL,溶液为H2SO3、NaH SO3的混合溶液,且物质的量相等,因Ka1>
=10-1.85可得c(HSO3-)=c(H2SO3),若Vo等于l0mL,溶液为H2SO3、NaH SO3的混合溶液,且物质的量相等,因Ka1>![]() ,溶液中c(HSO3-)>c(H2SO3),则Vo不等于l0mL,故A错误;
,溶液中c(HSO3-)>c(H2SO3),则Vo不等于l0mL,故A错误;
B.B点时,加入NaOH的体积为20mL,此时刚好生成NaHSO3,根据溶液呈电中性可得,c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-),故B正确;
C. A.pH=7.19时,溶液中c(H+)=10-7.19,由Ka2=![]() =10-7.19可得c(HSO3-)=c(SO32-),此时溶液呈碱性,则c(OH-)> c(H+),根据溶液呈电中性可得,c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-),求解可得,c(Na+)>3c(HSO3-),故C正确;
=10-7.19可得c(HSO3-)=c(SO32-),此时溶液呈碱性,则c(OH-)> c(H+),根据溶液呈电中性可得,c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-),求解可得,c(Na+)>3c(HSO3-),故C正确;
D.D点加入NaOH溶液体积为40mL时,溶质为Na2SO3,由Kh1= ![]() =
=![]() ==10-6.81,故D正确;
==10-6.81,故D正确;
故选A。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目