题目内容
I、摩尔盐制备:将绿矾(FeSO4·7H2O)硫酸铵以相等物质的量混合可制得摩尔盐晶体。根据下图回答
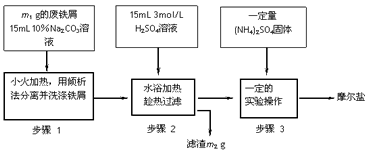
(1)步骤1中Na2CO3的主要作用是____________________。
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。
(1)除去铁屑表面的油污
(2)冷却结晶;过滤(或抽滤)
(3)溶液表面出现晶膜(或出现少量晶体);蒸干时溶液中的杂质离子会被带入晶体中,蒸干时晶体会受热分解或氧化
(4)250mL容量瓶
(5)D
(6)②边滴边振荡锥形瓶;④溶液由无色变为浅红色(红色或浅紫色),半分钟内不褪色
(7)MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O;14%
(2)冷却结晶;过滤(或抽滤)
(3)溶液表面出现晶膜(或出现少量晶体);蒸干时溶液中的杂质离子会被带入晶体中,蒸干时晶体会受热分解或氧化
(4)250mL容量瓶
(5)D
(6)②边滴边振荡锥形瓶;④溶液由无色变为浅红色(红色或浅紫色),半分钟内不褪色
(7)MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O;14%

练习册系列答案
相关题目
下列说法正确的是( )
| A、往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | B、在食醋总酸含量的测定中,没有控制好滴定终点,溶液显深红色,则必须重做实验 | C、阿司匹林具有抑制血小板凝聚作用,可用于治疗心血管疾病,因其具有较强的酸性,常制成阿司匹林肠溶片 | D、摩尔盐的制备实验中,将FeSO4和(NH4)2SO4混合液在蒸发皿中蒸发至有大量晶体析出,抽滤,并用少量酒精洗去晶体表面的水分 |
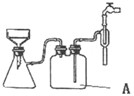 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
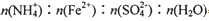 =_______
=_______