题目内容
I .向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至1000C失去结晶水,质量变为5.68 g
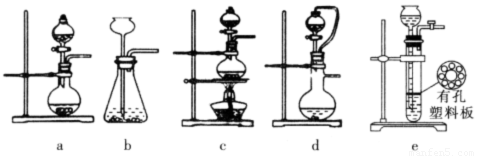
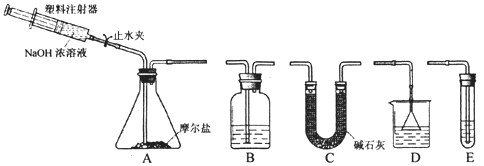
II. 选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。
根据上述实验回答下列问题:
(1) 实验I中,要检验FeSO4溶液中是否含有Fe3+常用的试剂是_______,“一系列操作”依次为_______、_______和过滤。
(2) 实验II中,选择的装置是A接_______接_______(填代号),A装置中未使用分液漏斗的理由是______________
(3) 向锥形瓶中加入NaOH溶液的操作方法是_______,吸收A中产生的气体所用试剂应是_______ .实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是______________。
(4) 根据上述实验数据计算,7.84g摩尔盐中SO42-的质量为_______g,摩尔盐中
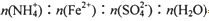 =_______
=_______ (2)C;D;NaOH溶液对分液漏斗活塞、旋塞的磨口腐蚀性强(或分液漏斗活塞、旋塞处会被NaOH溶液腐蚀导致粘结)
(3)打开止水夹,缓慢推压注射器活塞; H2SO4溶液;用注射器向A中注入空气,使装置中的氨气全部进入吸收液
(4)3.84;2∶1∶2∶6

[2012·合肥市第二次质检](13分)某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至5600C开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、过氧化氢等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol/L的Na2S2O3溶液滴定(滴定时的反应方程式:(I2+2S2O32-=2 I-+2S4O62-)。
滴定时Na2S2O3溶液应放在_________ (填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20. 00mL,其终点颜色变化为_________;加碘食盐样品中的碘元素含量是_________mg/kg(以含w的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴入淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加H2SO4,振荡 | 溶液变蓝色 |
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
| | |
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组 拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价 降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
|
物质 |
S |
S2Cl2 |
|
沸点/℃ |
445 |
138 |
|
熔点/℃ |
113 |
-76 |
该小组设计的制备装置如下图(夹持仪器已略去

回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是______。(填 写 字 母)
(3)装置B、C中的试剂分别是______。
(4)装置D中仪器a的作用是______。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生。用离子方程式表示产生该现象的原因____________。
[2012·合肥市第二次质检](13分)某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至5600C开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、过氧化氢等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol/L的Na2S2O3溶液滴定(滴定时的反应方程式:(I2+2S2O32-=2 I-+2S4O62-)。
滴定时Na2S2O3溶液应放在_________ (填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20. 00mL,其终点颜色变化为_________;加碘食盐样品中的碘元素含量是_________mg/kg(以含w的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
|
顺序 |
步骤 |
实验现象 |
|
① |
取少量纯净的NaCl,加蒸馏水溶解 |
溶液无变化 |
|
② |
滴入淀粉KI溶液,振荡 |
溶液无变化 |
|
③ |
然后再滴加H2SO4,振荡 |
溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因:__________________;根据学生乙的实验结果,请对学生甲的实验结果作出简要评价___________________________。
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
|
实验操作 |
实验现象及结论 |
|
|
|