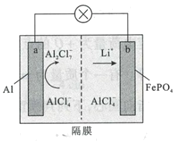
题目内容
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
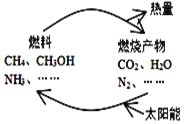
(1)在图构想的物质和能量循环中太阳能最终转化为______能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______极(填“正”或“负”),通入氧气一极的电极反应式:_________。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________。
【答案】热 AC 负 O2+4H++4e-=2H2O CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)根据图示分析判断;
(2)达到平衡时正逆反应速率相等,各物质的浓度、含量不变,据此分析判断;
(3)①在燃料电池中,通入燃料甲醇的电极是负极、通入氧气的电极是正极;②若用氢氧化钾溶液作电解液制成甲醇燃料电池,甲醇在负极发生氧化反应生成碳酸钾,据此书写电极反应式。
(1)由图可知,太阳能首先转化为化学能,其次化学能转化为热能,因此在图构想的物质和能量循环中太阳能最终转化为热能,故答案为:热;
(2)A.v正(H2O)=2v逆(CO2),可说明正逆反应速率相等,达到平衡状态,故A正确;
B.无论是否达到平衡状态,生成物的物质的量之比都等于化学计量数之比,即n(CH3OH)∶(O2)=2∶3,故B错误;
C.反应前后气体的体积不等,容器内压强保持不变,可说明达到平衡状态,故C正确;
D.因容器体积以及气体的质量不变,则容器内密度保持不变,不能用于判断是否达到平衡状态,故D错误;
故答案为:AC;
(3)①甲醇、氧气和稀硫酸制作燃料电池,反应中甲醇被氧化,应为电池的负极,正极发生还原反应,氧气被还原生成水,电极方程式为O2+4H++4e-=2H2O,故答案为:负;O2+4H++4e-=2H2O;
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,甲醇在负极发生氧化反应生成碳酸钾,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O。