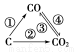
题目内容
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
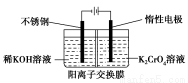
下列说法不正确的是( )
A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nk/nCr)为d,则此时铬酸钾的转化率为1-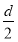
D
【解析】观察实验装置,阴极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,阳极室OH-放电,导致H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O右移,从而在阳极区得到K2Cr2O7,故A、B、C正确。D项,设最初阳极室中的K2CrO4为1 mol,通电后转化的K2CrO4为x mol,依题意有2(1-x)+
Cr2O72-+H2O右移,从而在阳极区得到K2Cr2O7,故A、B、C正确。D项,设最初阳极室中的K2CrO4为1 mol,通电后转化的K2CrO4为x mol,依题意有2(1-x)+ ×2=d×1,x=2-d,K2CrO4的转化率为:
×2=d×1,x=2-d,K2CrO4的转化率为: ×100%,故D项错误。
×100%,故D项错误。

练习册系列答案
相关题目