��Ŀ����
����Ŀ����ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�У���H2����H1���ǣ� ��
A.H2 ��g��+Cl2��g���T2HCl��g������H1 ![]() H2��g��+
H2��g��+ ![]() Cl2��g���THCl��g������H2
Cl2��g���THCl��g������H2
B.2H2��g��+O2 ��g���T2H2O��g������H1 2H2 ��g��+O2 ��g���T2H2O��l������H2
C.CO��g��+ ![]() O2��g���TCO2��g������H1 2CO��g��+O2��g���T2CO2��g������H2
O2��g���TCO2��g������H1 2CO��g��+O2��g���T2CO2��g������H2
D.S��s��+O2��g���TSO2 ��g������H1 S��g��+O2��g���TSO2 ��g������H2
���𰸡�A
���������⣺A����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ����û��Ϸ�Ӧ�Ƿ��ȵģ������ʱ�ֵ�Ǹ�ֵ��2��H2=��H1 �� �ʡ�H1����H2 �� ����ȷ��
B�����ʵ�ȼ�շ�Ӧ�Ƿ��ȵģ������ʱ��Ǹ�ֵ��Һ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȵģ��ʡ�H1����H2 �� �ʴ���
C����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ����û��Ϸ�Ӧ�Ƿ��ȵģ������ʱ�ֵ�Ǹ�ֵ��2��H1=��H2 �� ��H1����H2 �� �ʴ���
D�����ʵ�ȼ�շ�Ӧ�Ƿ��ȵģ������ʱ��Ǹ�ֵ���������Ϊ��̬����Ҫ����������������ȼ�շ��ȶ࣬���ԡ�H1����H2 �� �ʴ���
��ѡA��
A��Һ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȹ��̣�
B���������Ϊ��̬����Ҫ����������
C��̼������ȫȼ�շ��ȶ��ڲ���ȫȼ�շŵ��ȣ�
D����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ�

����Ŀ����50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ� 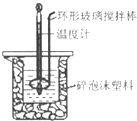
��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� | |||
HCl | NaOH | ƽ��ֵ | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��1���ڸ�ʵ���У���ȡ50mL�����NaOH��Һ����Ҫ�õ��IJ���������
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ������
��3��ijͬѧʵ���¼���������ϱ���ʾ�����м�¼����ֹ�¶���ָ�¶ȣ�
��4�������ʵ�鷢���кͷ�Ӧʱ�ų�������ΪkJ[�кͺ����ɵ���Һ�ı�����c=4.18J��g�棩��1 �� ϡ��Һ���ܶȶ�Ϊ1gcm��3]��
��5�������50mL 0.55mol/L�İ�ˮ��NH3H2O������NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����к��ȡ�H��ƫ����ԭ���� ��
