题目内容
【题目】某学习小组用如图所示装置A,B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题. 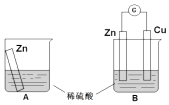
(1)A烧杯中反应的离子方程式为 .
(2)B中Zn板是极,发生的电极反应是 , Cu板上的现象是 , 发生的电极反应是 .
(3)从能量转化的角度来看,A,B中反应物的总能量(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为 , B中主要是将化学能转变为 .
(4)该小组同学反思原电池的原理,其中观点正确的是(填字母序号).
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生.
【答案】
(1)Zn+2H+═Zn2++H2↑
(2)负;Zn﹣2e﹣═Zn2+;有无色气体产生;2H++2e﹣═H2↑
(3)大于;热能;电能
(4)ABD
【解析】解:(1)锌与氢离子反应生成锌离子与氢气,离子方程式为Zn+2H+═Zn2++H2↑,所以答案是:Zn+2H+═Zn2++H2↑;(2)锌铜稀硫酸原电池中,活泼金属锌作负极,电极反应为Zn﹣2e﹣═Zn2+ , 氢离子在正极铜上得电子产生氢气,电极反应为2H++2e﹣═H2↑,所以答案是:负;Zn﹣2e﹣═Zn2+;有无色气体产生;2H++2e﹣═H2↑;(3)A烧杯中温度升高,该反应是放热反应,所以反应物总能量大于生成物总能量;该反应将化学能转化成热能,原电池是将化学能转化成电能,所以答案是:大于;热能;电能;(4)A.原电池要有自发进行的氧化还原反应发生,一定有电子的转移,故A正确; B.原电池的构成条件必须有两个电极,故B正确;
C.活泼金属作负极失电子发生氧化反应,正极上得电子发生还原反应,一般负极溶解,正极质量增重或析出气体,故C错误;
D.负极发生氧化反应,正极发生还原反应,故D正确;
所以答案是:ABD.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案