题目内容
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:__________________________。
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是_______(写电子式)。
(3).已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知道12.0 g碳完全燃烧,放出热量为b kJ。则热化学方程式C(s)+ O2(g)===CO(g) ΔH=w,
O2(g)===CO(g) ΔH=w,
w等于 _____________
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平) 回答问题:
①还原产物的化学式为 _______________;
②配平后的化学方程式是 ________________________________ 。
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
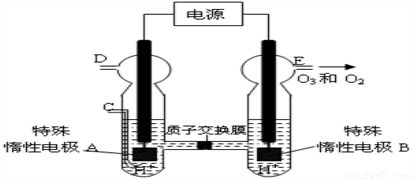
图中阴极为______(填“A”或“B”)。
若C处不通入O 2 ,D、E处分别收集到11.2L和4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为___________(忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为:________________________________。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 4NO2 (g)+ O2(g) ΔH1
4NO2 (g)+ O2(g) ΔH1 2NH3(g) ΔH=-akJ/mol达到化学平衡时,下列说法一定正确的是
2NH3(g) ΔH=-akJ/mol达到化学平衡时,下列说法一定正确的是
