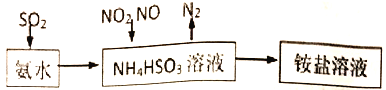
题目内容
【题目】有研究人员设计了如下利用含硫物质热化学循环实现太阳能的转化与存储的过程.

回答下列问题:
(1)反应I中,主要能量转化形式为__________能转化为_____________能。
(2)S在元素周期表中位于第___________周期第_____________族。
(3)下列事实中,能说明硫的非金属性比碳强的是__________________(填标号)。
A.H2SO3的酸性比H2CO3的酸性强
B.在硫与碳的化合物CS2中S显负价
C.硫的单质的硬度比金刚石低
(4)配平反应Ⅱ的化学方程式:________SO2+_________H2O=______H2SO4+______S,该反应中氧化剂是_______________。
(5)通过反应Ⅲ也可以不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为_____________。
【答案】热 化学 三 VIA B 3 2 2 1 SO2 化学电池
【解析】
(1)由图示转化可知,反应I中,主要能量转化形式为热能转化为化学能;
(2)硫原子的原子核外有三个电子层,因此硫元素位于元素周期表的第三周期;其最外层电子数为6,因此位于周期表的第VIA族;
(3)A. 由酸性比较非金属性强弱时,应用最高价氧化物对应水化物的酸性去比较,S的最高价氧化物对应水化物应为H2SO4,不能用H2SO3,A错误;
B. CS2中S显负价,说明S得电子能力比C强,因此说明硫的非金属性比C强,B正确;
C. 无法通过单质的硬度来比较非金属性强弱,C错误;
答案选B;
(4)在该反应中,SO2的S由+4价升高到+6价,由+4价降低到0价,根据化合价升降守恒(得失电子守恒)和原子守恒配平方程式,配平后的系数为3、2、2、1,该反应中SO2得电子发生还原反应,因此其为氧化剂;
(5)不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为化学电池。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案