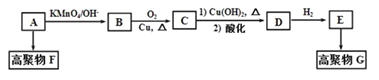
题目内容
【题目】按如图所示装置进行实验,并回答下列问题。
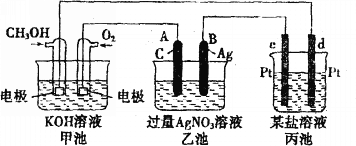
(1)甲池是_________池,通入CH3OH(甲醇)的电极作为_______极,电极反应式为________________________________________________。
(2)乙池是________池,A电极名称为______极,电极反应式为_______________________,乙池中的总反应化学方程式为________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______g;此时丙装置中_____________(填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
【答案】 原电池 负 CH3OH - 6e- + 8OH-= CO32- + 6H2O 电解 阳 2H2O-4e- =O2↑++4H+ 或4OH--4e-=O2↑+2H2O 4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3 减小 10.8 【答题空10】d bd
4Ag+O2↑+4HNO3 减小 10.8 【答题空10】d bd
【解析】(1)甲池是燃料电池是原电电池装置,通入燃料CH3OH的电极是负极;甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:原电池;负;CH3OH-6e-+8OH-═6H2O+CO32-;
(2)乙为电解池,A与原电池正极相连,为电解池的阳极,发生氧化反应,电极方程式为4OH--4e-═O2↑+2H2O,乙池中电解硝酸银溶液,阳极生成氧气,阴极生成银,电解总反应式为4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3,生成H+,则溶液pH减小,故答案为:电解;阳;4OH--4e-═O2↑+2H2O;4AgNO3+2H2O
4Ag+O2↑+4HNO3,生成H+,则溶液pH减小,故答案为:电解;阳;4OH--4e-═O2↑+2H2O;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;减小;
4Ag+O2↑+4HNO3;减小;
(3)当甲池中消耗O2 0.56L(标准状况下)时,消耗氧气的物质的量为![]() =0.025mol,转移电子0.025mol ×4=0.1mol,B(Ag)极析出的是金属银,质量增加0.1mol×108g/mol =10.8g,此时丙池中d电极上发生还原反应,析出1.20g某金属,转移电子为0.1mol,反应过程中可能金属阳离子放电后,溶液中的氢离子继续放电。当析出一价金属时,其摩尔质量≥
=0.025mol,转移电子0.025mol ×4=0.1mol,B(Ag)极析出的是金属银,质量增加0.1mol×108g/mol =10.8g,此时丙池中d电极上发生还原反应,析出1.20g某金属,转移电子为0.1mol,反应过程中可能金属阳离子放电后,溶液中的氢离子继续放电。当析出一价金属时,其摩尔质量≥![]() =12g/mol,当析出的是二价金属,则其摩尔质量≥
=12g/mol,当析出的是二价金属,则其摩尔质量≥![]() ×2=24g/mol,a.MgSO4溶液中镁离子不能放电生成金属镁,错误;b.CuSO4溶液中铜离子可以放电生成铜,之后溶液中的氢离子放电,正确;c.NaCl溶液中的钠离子不能放电,不能析出金属,错误;d.AgNO3溶液的银离子可以放电形成银,之后氢离子放电,正确;故选bd;故答案为:10.8; d;bd 。
×2=24g/mol,a.MgSO4溶液中镁离子不能放电生成金属镁,错误;b.CuSO4溶液中铜离子可以放电生成铜,之后溶液中的氢离子放电,正确;c.NaCl溶液中的钠离子不能放电,不能析出金属,错误;d.AgNO3溶液的银离子可以放电形成银,之后氢离子放电,正确;故选bd;故答案为:10.8; d;bd 。